Содержание
Принцип работы катализатора на авто. Устройство. Функционал. Срок службы.
Интересные статьи
- Для чего нужна прошивка под Евро-2
- Самые дорогие катализаторы для сдачи
- Какие драгоценные металлы содержатся в катализаторе?
- Состав автомобильного катализатора
- Что лучше обманка или прошивка катализатора?
- Зачем скупают б/у автомобильные катализаторы?
- Где находится катализатор в автомобиле
- Промывка катализатора. Как правильно прочистить катализатор?
Выхлопные газы автомобиля содержат в своем составе достаточно много токсичных компонентов. Чтобы защитить воздух от их попадания на машинах используется специальное приспособление, которое получило название каталитический нейтрализатор. Он используется на автомобилях, работающих за счет двигателей внутреннего сгорания. Этот компонент подходит для машин, заправляемых бензином либо дизельным топливом. Если знать принципы работы катализаторов, то получится понять всю важность его функционирования, а также оценить последствия, возникающие при его удалении.
Этот компонент подходит для машин, заправляемых бензином либо дизельным топливом. Если знать принципы работы катализаторов, то получится понять всю важность его функционирования, а также оценить последствия, возникающие при его удалении.
Оглавление
Устройство катализатора
Как функционирует катализатор
Срок службы катализатора
Можно ли удалить катализатор
Устройство катализатора
Нейтрализатор – это важная часть выхлопной системы авто. Он расположен сразу за выпускным коллектором мотора. Блок имеет сложную структуру и состоит из:
- Корпуса из металла, который снабжен патрубками на входе и выходе;
- Монолитного керамического блока внутри, представляющего собой пористую структуру, имеющую совокупность ячеек, заметно увеличивающих площадь контакта выхлопов с рабочей поверхностью;
- Слоя каталитического вещества – это особое напыление на ячейках керамического блока, которое состоит из палладия, платины и родия.
 В самых последних моделях напыление иногда делают из золота, так как это более дешевый драгметалл;
В самых последних моделях напыление иногда делают из золота, так как это более дешевый драгметалл; - Металлического кожуха, который отвечает за теплоизолирующие функции и защищает катализатор от физических повреждений.
Основная функция каталитического нейтрализатора – это обезвреживание трех базовых токсичных компонентов отработавших выхлопных газов, что и позволило ему заработать свое наименование – трехкомпонентный. Вот эти вещества, которые он нейтрализует:
- Окислы азота NOx – одно из веществ смога, из-за него возникают кислотные дожди, которые опасны для людей;
- Угарный газ СО – если его концентрация в атмосфере составляет 0,1% или более, то это смертельно опасно;
- Углеводороды CH – одно из веществ смога, являются канцерогенами.
Как функционирует катализатор
Принцип работы катализатора имеет следующий вид на практике:
- Из мотора выпускаются выхлопные газы, проникающие внутрь керамических блоков, где они проходят далее в ячейки и полностью их заполняют;
- Металлы-катализаторы инициируют окислительную реакцию, благодаря чему несгоревшие углеводороды переходят в состояние водяного пара, а угарный газ становится углекислым;
- Восстановительный компонент родий отвечает за преобразование оксида азота в азот, не способный нанести вред;
- Все отработавшие газы после очищения поставляются в атмосферу.

Для автомобилей с дизельным ДВС одновременно с катализатором всегда устанавливается сажевый фильтр. Эти два компонента могут совмещаться в совокупную цельную структуру.
Эффективность нейтрализации сильно зависит от рабочей температуры узла. Реальное преобразование стартует при температуре более 300 градусов. Идеальный разброс температуры для работы компонента – это 400-800 градусов. Если катализатор работает в диапазоне 800-1000, то отмечается ускоренное старение компонента. При продолжительной эксплуатации нейтрализатора при температуре более 1000 градусов он стремительно разрушается.
Срок службы катализатора
Для катализатора усредненное значение ресурса примерно 100-150 тыс. км. пробега и зависит от условий езды. При верно выбранных условиях он способен продержаться до 200 тыс. км. Преждевременный износ сопряжен с неисправностями мотора, низким качеством топлива. Если смесь обеднена, то случается перегрев, а при сильно обогащенной блок засоряется остатками недогоревшего топлива, поэтому не удается протекать требуемым химическим реакциям. Это вызывает значительное снижение срока службы блока катализации.
Это вызывает значительное снижение срока службы блока катализации.
Еще одна распространенная причина проблемы – механические повреждения, которые возникают в результате ударов, вибрации и прочих воздействий. Они приводят к ускоренному разрушению блоков.
Если возникают неисправности, то работа катализатора ухудшается, поэтому второй лямбда-зонд фиксирует изменение параметров. В данном случае ЭБУ сообщает о неисправности, выдает ошибку на приборной панели. Признаки выхода катализатора из строя – дребезжание, ухудшение динамики, увеличение топливного расхода. В таком случае каталитической нейтрализатор требуется заменить на новый. Невозможно восстановить или почистить элемент, а высокая цена этой детали вынуждает многих автомобилистов просто удалить ее.
Можно ли удалить катализатор
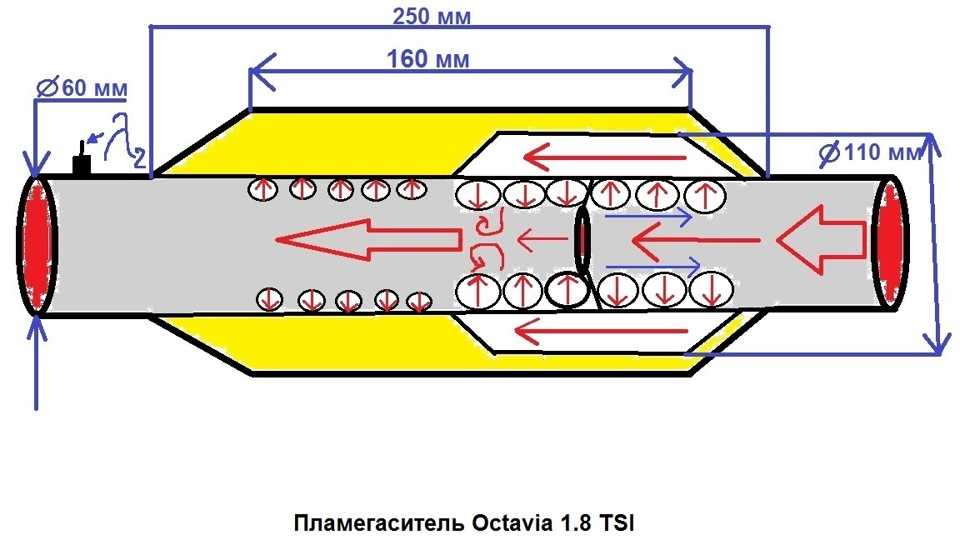
Когда нейтрализатор удаляют, на его место ставят пламегаситель. Он предназначен для выравнивания потока выхлопа. Он монтируется для устранения шумов, возникающих при удалении катализатора.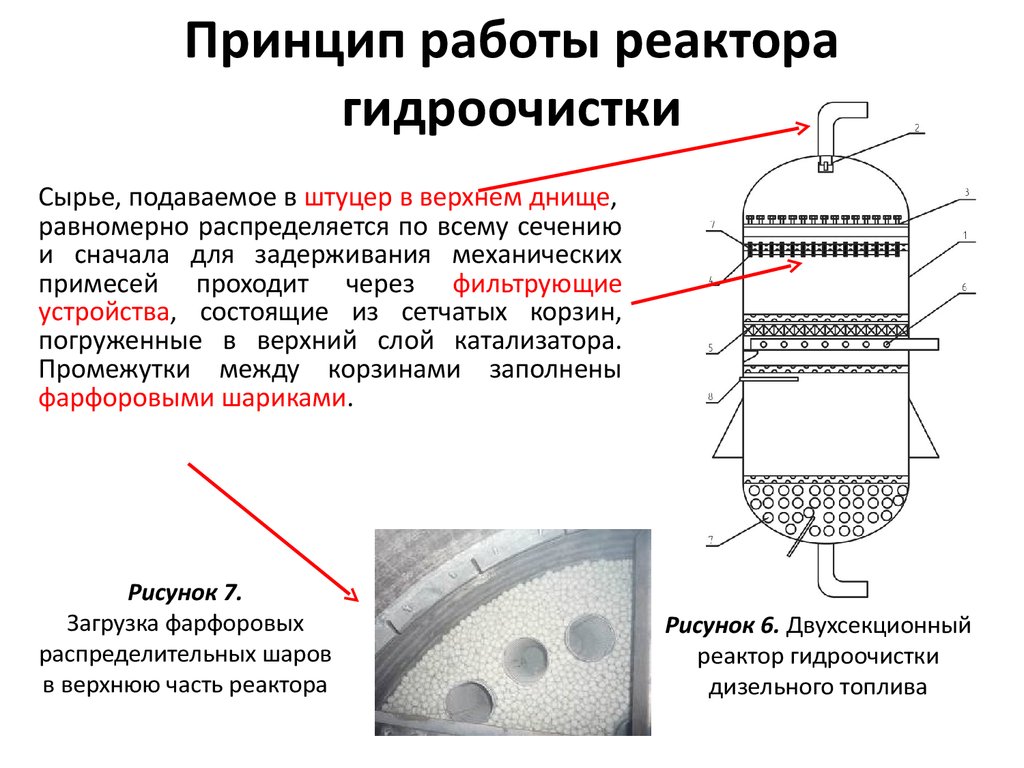 Если выбрать именно удаление, то следует снять устройство целиком, а не пробивать в нем отверстия, как советуют некоторые автомобилисты.
Если выбрать именно удаление, то следует снять устройство целиком, а не пробивать в нем отверстия, как советуют некоторые автомобилисты.
Для авто, которые соответствуют стандартам Евро-3, требуется не только удалить катализатор, но и перепрошить ЭБУ. Допускается установка эмулятора сигнала кислородного датчика, чтобы избавиться от необходимости в изменении прошивки.
Самое правильное решение при поломке катализатора – это замена на оригинальный компонент в условиях специализированного сервиса. Это позволит исключить вмешательство в конструкцию авто и сохранение экологического класса, заявленного производителем.
Принцип работы катализатора
Катализатор — как правильно работать?
Катализатор, также известный как каталитический нейтрализатор, является важной частью выхлопной системы, установленной практически на всех современных транспортных средствах. Его основная задача — уменьшить количество вредных соединений, которые могут попасть в атмосферу. В первую очередь это: окись углерода (СО), углеводороды (СН) и оксиды азота (NOx).
В первую очередь это: окись углерода (СО), углеводороды (СН) и оксиды азота (NOx).
Как это работает?
Работа реактора основана на химической реакции соединений, содержащихся в выхлопных газах, с катализатором, которые представляют собой редкие металлы (включая иридий и платину), заключенные в металлическую банку.
В бензиновых двигателях так называемые трехходовые катализаторы, известные как TWC (Трехсторонний катализатор). Их название происходит от одновременной реакции с тремя группами вредных соединений: эти катализаторы восстанавливают как оксиды азота, так и окисляют углеводороды и оксид углерода.
Иная ситуация в дизельных двигателях. Как и в бензиновых установках, реакторы окисляют соединения СН и СО, но они не уменьшают вредные оксиды азота одновременно.
Последние уменьшаются за счет рециркуляции выхлопных газов в самом двигателе. Так называемый твердые (сажа) частицы, которые могут быть уменьшены путем перезарядки.
Так называемый твердые (сажа) частицы, которые могут быть уменьшены путем перезарядки.
Когда это работает?
бортовые мини погрузчики Bawoo
Катализатор не работает сразу после запуска двигателя: минимальная температура, при которой он начинает уменьшать количество вредных веществ в выхлопных газах, составляет около 300 градусов по Цельсию (катализаторы размещаются как можно ближе к выпускному коллектору для быстрого нагрева).
В свою очередь, фактическая рабочая температура составляет около 800 градусов Цельсия. В последних моделях автомобилей используются два катализатора: первый работает в так называемых холодный старт, второй при нормальной работе двигателя.
Что ломается?
Средний катализатор сохраняет свои свойства до 100 000 километров пробега (в некоторых случаях долговечность каталитического вклада может быть намного выше). Небрежность в результате отсутствия технических проверок и механических повреждений способствуют значительному сокращению срока его службы.
В первом случае это o масло или охлаждающая жидкость, попавшие в выпускную систему, в другом — быстрое охлаждение катализатора (например, после вождения в глубокую лужу на проезжей части) или его повреждение, например, в результате внезапного столкновения с высокой бордюром.
В дизельных двигателях проблема с катализатором также может быть связана с отсутствием его проходимости.
Почему? Установки, работающие на дизельном топливе, выделяют большее количество твердых частиц, что увеличивает вероятность засорения конвертера. Для оценки проходимости катализатора, измерение так называемого противодавление выхлопных газов при работающем двигателе на холостых оборотах.
Катализатор и LPG
В правильно функционирующей газовой установке смесь пропан-бутан не оказывает неправильного воздействия на каталитическую систему. Проблема может заключаться в установках СНГ самого старого поколения без электронного регулирования состава газовоздушной смеси.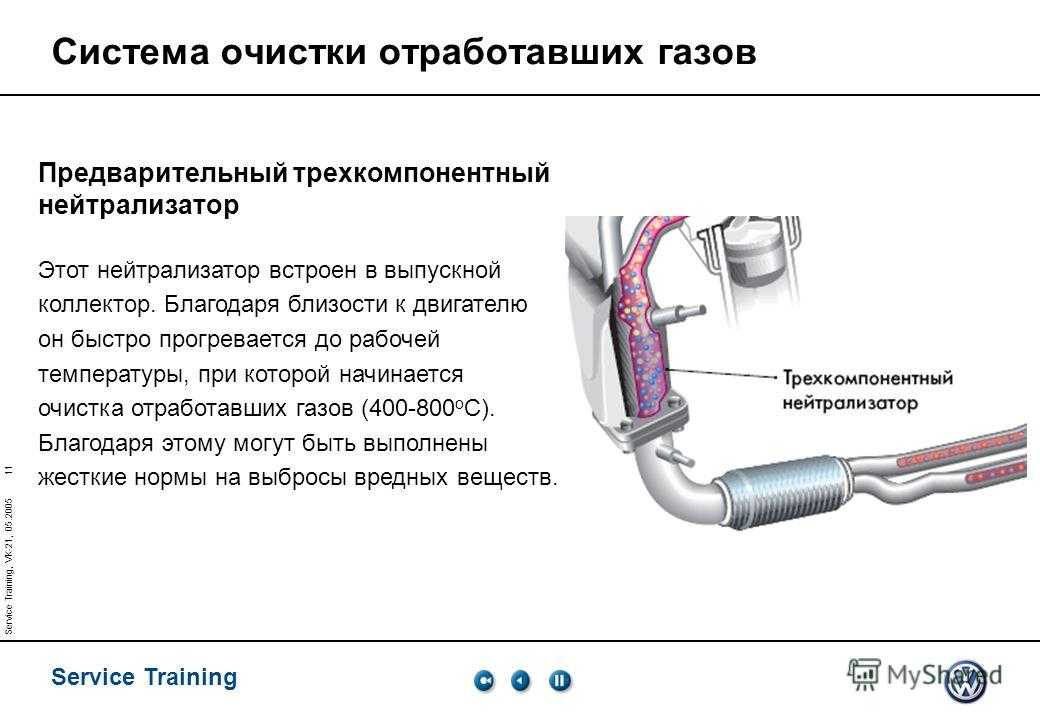
В этих установках используется смеситель (так называемое сопло Вентури), и состав выхлопных газов зависит от его регулирующих свойств, что во многих случаях неуместно. Как следствие, это приводит к быстрому снижению каталитических свойств и повреждению самого реактора.
Что такое катализ?
от azoHAaccnt | 26 февраля 2018 г. | Блог
Катализ — это процесс модификации химической реакции с использованием катализатора. Этот процесс работает только с химическими веществами, у которых уже есть реакция, и используется для ускорения реакции в коммерческих целях. Катализ происходит быстрее, чем стандартная химическая реакция, потому что катализаторы требуют меньше энергии активации, которая представляет собой минимальный уровень энергии, необходимый для инициирования химической реакции.
В этом сообщении в блоге будут изложены принципы катализа и его различные типы.
Принцип работы катализатора
Когда химическое вещество помещается с совместимым катализатором, уменьшается свободная энергия, необходимая химическому веществу для достижения переходного состояния для данной конкретной реакции. Катализаторы могут влиять на реакционную среду в зависимости от конкретных требований реакции.
Катализаторы могут влиять на реакционную среду в зависимости от конкретных требований реакции.
Например, катализаторы могут выделять больше тепла, образовывать специфические промежуточные соединения, которые не образуются естественным путем, связывать реагенты для поляризации связей или вызывать диссоциацию реакций обратно в их реактивные формы.
Типы катализаторов
Существует два основных типа катализаторов, используемых для катализа; гетерогенный или гомогенный. Гетерогенный катализатор имеет молекулы, которые не находятся в той же фазе, что и реагенты, тогда как молекулы гомогенного катализатора находятся в той же фазе, что и реагенты.
Если вы хотите узнать больше о процессах, связанных с исследованиями катализа, прочитайте нашу статью: Что такое TPR?
Обычно гетерогенный катализатор является твердым, тогда как реагенты являются газообразными или жидкими. Реагенты адсорбируются на активных центрах поверхности гетерогенного катализатора, и происходит взаимодействие.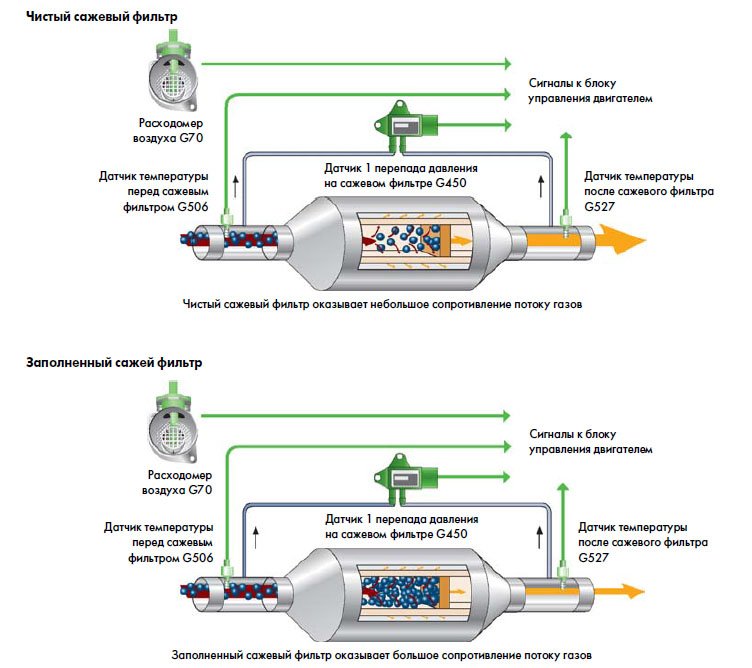 Это взаимодействие заставляет молекулы становиться более реактивными.
Это взаимодействие заставляет молекулы становиться более реактивными.
Электрокатализатор представляет собой гетерогенный катализатор, который используется специально в разработке топливных элементов для улучшения свойств и работы топливных элементов.
Гомогенные катализаторы находятся в той же фазе, что и реагент, обычно газ или жидкость. К этому типу катализаторов обычно применяются принципы гетерогенного катализатора.
Органокатализ — это форма катализа, которая может осуществляться с использованием гомогенного катализатора. Органокатализ — это изучение органических катализаторов, представляющих собой небольшие органические молекулы.
Подробнее: Инструменты для исследования катализа
Катализ в Hiden Analytical
Компания Hiden Analytical имеет более чем 30-летний опыт проектирования, разработки и производства масс-спектрометров для специализированного мониторинга технологических процессов и передовых исследовательских приложений.
У нас есть ряд продуктов, подходящих для анализа катализа, в том числе наш CATLAB-PCS, который обеспечивает полностью автоматизированные и точные исследования химии активной поверхности, возможность оптимизировать каталитическую активность и быстрый динамический скрининг.
Метод дифференциальной электрохимической масс-спектрометрии DEMS идеально подходит для анализа активности электрокатализаторов. Система Hiden HPR-40 DEMS предназначена для дифференциальной электрохимической масс-спектрометрии. Система включает ячейки DEMS, разработанные в сотрудничестве с Национальной лабораторией Лоуренса в Беркли, Калифорния, США.
Если вам нужна дополнительная информация о продуктах Hiden Analytical для исследования и анализа катализа, отправьте нам сообщение.
катализ | Химия, классификация и химические реакции
наночастицы: перекись водорода
Посмотреть все СМИ
- Ключевые люди:
- Йонс Якоб Берцелиус
Вильгельм Оствальд
Сидни Альтман
Томас Роберт Чех
Ричард Ф. Хек
Хек
- Похожие темы:
- кислотно-щелочной катализ
каталитический яд
промоутер
асимметричный органокатализ
гетерогенный катализ
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
катализ , в химии изменение скорости химической реакции, обычно ускорение, путем добавления вещества, не израсходованного в ходе реакции. Скорость химических реакций, то есть скорость, с которой они происходят, зависит от ряда факторов, включая химическую природу реагирующих частиц и внешние условия, которым они подвергаются. Особым явлением, связанным со скоростями химических реакций и представляющим большой теоретический и практический интерес, является катализ — ускорение химических реакций веществами, не расходующимися в самих реакциях, — веществами, называемыми катализаторами. Изучение катализа представляет теоретический интерес из-за того, что оно раскрывает фундаментальную природу химических реакций; на практике изучение катализа важно, потому что успех многих промышленных процессов зависит от катализаторов. По сути, своеобразный феномен жизни вряд ли был бы возможен без биологических катализаторов, называемых ферментами.
По сути, своеобразный феномен жизни вряд ли был бы возможен без биологических катализаторов, называемых ферментами.
В катализируемой реакции катализатор обычно вступает в химическую реакцию с реагентами, но в конечном итоге регенерируется, поэтому количество катализатора остается неизменным. Поскольку катализатор не расходуется, каждая молекула катализатора может вызывать превращение многих молекул реагентов. Для активного катализатора число молекул, преобразуемых в минуту одной молекулой катализатора, может достигать нескольких миллионов.
Если данное вещество или комбинация веществ подвергается двум или более одновременным реакциям, в результате которых образуются разные продукты, на распределение продуктов может влиять использование катализатора, который избирательно ускоряет одну реакцию по сравнению с другой(и). Путем выбора подходящего катализатора можно заставить протекать конкретную реакцию, практически исключая другую. Многие важные приложения катализа основаны на селективности такого рода.
Поскольку обратная химическая реакция может протекать путем обращения стадий, составляющих механизм прямой реакции, катализатор данной реакции ускоряет реакцию в обоих направлениях одинаково. Следовательно, катализатор не влияет на положение равновесия химической реакции; оно влияет только на скорость достижения равновесия. Очевидными исключениями из этого обобщения являются те реакции, в которых один из продуктов также является катализатором реакции. Такие реакции называются автокаталитическими.
Известны также случаи, когда добавление постороннего вещества, называемого ингибитором, снижает скорость химической реакции. Это явление, правильно называемое торможением или замедлением, иногда называют отрицательным катализом. Концентрации ингибитора в некоторых случаях могут быть намного ниже концентраций реагентов. Ингибирование может быть следствием (1) уменьшения концентрации одного из реагентов из-за образования комплекса между реагентом и ингибитором, (2) уменьшения концентрации активного катализатора («отравление» катализатора) из-за комплексообразование между катализатором и ингибитором или (3) прекращение цепной реакции из-за разрушения носителей цепи ингибитором.
Термин катализ (от греческого kata- «вниз» и lyein «ослаблять») был впервые использован великим шведским химиком Йонсом Якобом Берцелиусом в 1835 году для сопоставления группы наблюдений, сделанных другие химики в конце 18 — начале 19 вв. К ним относятся усиленное превращение крахмала в сахар кислотами, впервые обнаруженное Готлибом Сигизмундом Константином Кирхгофом; Наблюдения сэра Хамфри Дэви о том, что платина ускоряет сгорание различных газов; открытие устойчивости пероксида водорода в кислом растворе, но его разложения в присутствии щелочи и таких металлов, как марганец, серебро, платина, золото; и наблюдение, что окисление спирта в уксусную кислоту происходит в присутствии мелкоизмельченной платины. Агенты, способствующие этим различным реакциям, были названы катализаторами, и Берцелиус постулировал, что в таких процессах действует особая неизвестная каталитическая сила.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.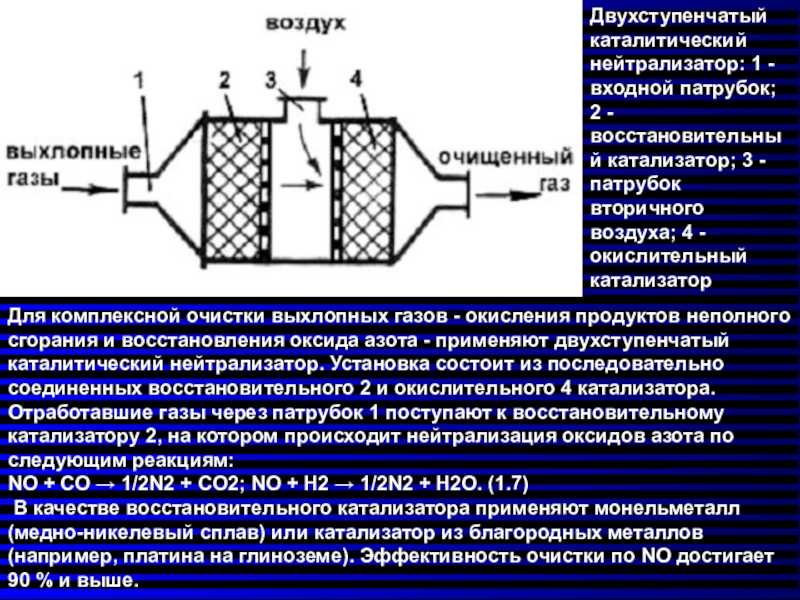
Подпишитесь сейчас
В 1834 году английский ученый Майкл Фарадей исследовал способность платиновой пластины осуществлять рекомбинацию газообразного водорода и кислорода (продуктов электролиза воды) и замедление этой рекомбинации присутствием других газов, таких как как этилен и окись углерода. Фарадей утверждал, что для активности необходима совершенно чистая металлическая поверхность (на которой замедляющие газы могут конкурировать с реагирующими газами и таким образом подавлять активность), концепция, которая, как позже будет показано, в целом важна для катализа.
Многие из примитивных технических искусств включали бессознательное применение катализа. Ферментация вина до уксусной кислоты и производство мыла из жиров и щелочей были хорошо известны в ранней истории человека. Серная кислота, полученная путем обжига смесей серы и селитры (нитрата натрия), была ранним предшественником камерного процесса производства серной кислоты, в котором окисление диоксида серы ускорялось за счет добавления оксидов азота. (Механизм последнего процесса был предложен сэром Хамфри Дэви в 1812 году на основе экспериментов, проведенных другими.)
(Механизм последнего процесса был предложен сэром Хамфри Дэви в 1812 году на основе экспериментов, проведенных другими.)
В 1850 году при изучении гидролиза или инверсии тростникового сахара было разработано понятие скорости реакции. Термин инверсия относится к изменению вращения, которому подвергается монохроматический свет при его прохождении через реакционную систему, параметр, который легко измерить, тем самым облегчая изучение реакции. Было обнаружено, что в любой момент скорость инверсии была пропорциональна количеству тростникового сахара, претерпевающего превращение, и что скорость ускорялась в присутствии кислот. (Позже было показано, что скорость инверсии прямо пропорциональна силе кислоты.) Эта работа была отчасти предшественницей более поздних исследований скорости реакции и ускоряющего влияния более высокой температуры на эту скорость, проведенных Дж. ван ’т Хофф, Сванте Аррениус и Вильгельм Оствальд, все они сыграли ведущую роль в развивающейся науке физической химии. Работа Оствальда по скорости реакции привела его в0s для определения катализаторов как веществ, которые изменяют скорость данной химической реакции без изменения энергетических факторов реакции.
Работа Оствальда по скорости реакции привела его в0s для определения катализаторов как веществ, которые изменяют скорость данной химической реакции без изменения энергетических факторов реакции.
Это утверждение Оствальда было памятным достижением, поскольку оно подразумевало, что катализаторы не меняют положение равновесия в реакции. В 1877 году Жорж Лемуан показал, что разложение иодистоводородной кислоты на водород и йод достигает одной и той же точки равновесия при 350°C (660°F), 19%, независимо от того, протекает ли реакция быстро в присутствии платиновой губки или медленно в присутствии платиновой губки. газовая фаза. Это наблюдение имеет важное следствие: катализатор прямого процесса в реакции является также катализатором и обратной реакции. П.Э.М. Бертло, выдающийся французский химик, подтвердил это наблюдение в 1879 г.с жидкими системами, когда он обнаружил, что реакция органических кислот и спиртов, называемая этерификацией, катализируется присутствием небольших количеств сильной неорганической кислоты, как и обратный процесс, гидролиз сложных эфиров (реакция между эфиром и вода).
Преднамеренное применение катализаторов в промышленных процессах было предпринято в 19 веке. П. Филипс, английский химик, запатентовал использование платины для окисления сернистого газа воздухом до трехокиси серы. Его процесс использовался какое-то время, но от него отказались из-за потери активности платиновым катализатором. Впоследствии было обнаружено, что причиной являются яды в реагентах, и на рубеже 20-го века этот процесс стал техническим успехом. В 1871 г. был разработан промышленный способ окисления соляной кислоты в хлор в присутствии солей меди, пропитанных глиняным кирпичом. Полученный хлор использовали для производства хлорной извести (сухого вещества, выделяющего хлор при обработке кислотой) путем реакции с известью. Опять же, в этой реакции наблюдалось, что одинаковое равновесие достигается в обоих направлениях. Кроме того, оказалось, что чем ниже температура, тем больше равновесное содержание хлора; рабочая температура 450 ° C (840 ° F) производила максимальное количество хлора за удобное время.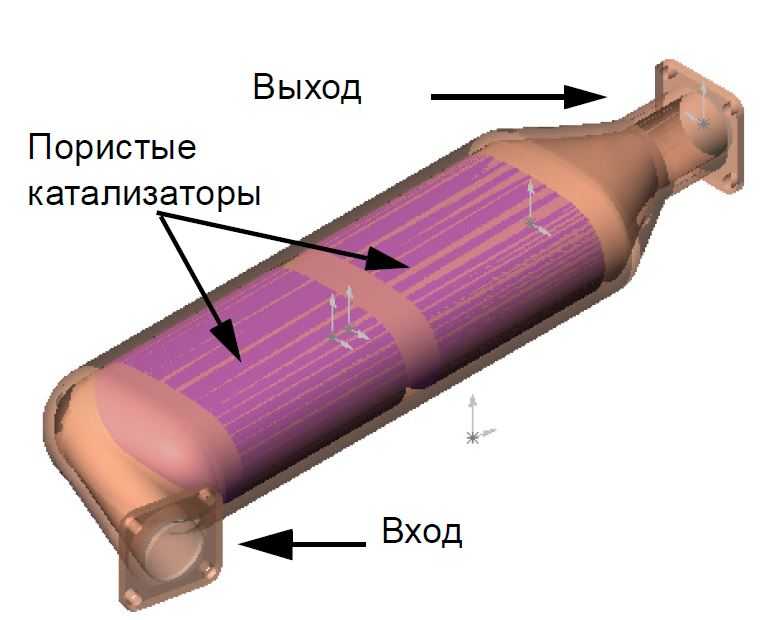
 В самых последних моделях напыление иногда делают из золота, так как это более дешевый драгметалл;
В самых последних моделях напыление иногда делают из золота, так как это более дешевый драгметалл;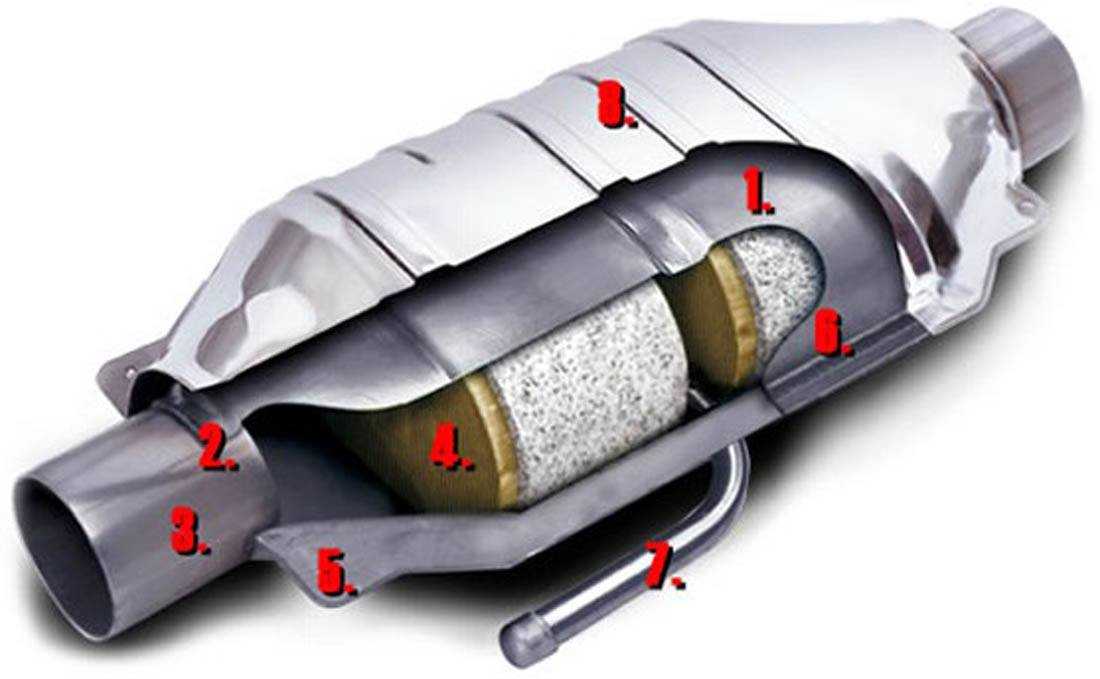
 Хек
Хек