Содержание
Какой принцип работы контроллера для аккумулятора
Статья обновлена: 2021-05-19
Контроллер Li-ion аккумулятора или батареи – это электронная плата, которая контролирует работу АКБ и не допускает опасных ситуаций при ее эксплуатации. Это краткий ответ на вопрос, что такое контроллер батареи. Чаще всего его называют BMS платой – от словосочетания Battery Management System.
Ее основные компоненты – это резисторы, MOSFET-транзисторы, накопительный конденсатор и микросхема защиты. Они оберегают батарею от неполадок по цепи питания, не допускают критических отклонений рабочих параметров и преждевременного выхода из строя.
Как выглядит контроллер аккумулятора?
Внешний вид контроллера зависит от типа элементов питания, для которых он предназначен. Например, для защиты Li-ion аккумуляторов популярного типоразмера 18650 используются миниатюрные платы, которые привариваются с помощью сварочной ленты к одному из контактов. В результате незащищенный аккум становится защищенным, его диаметр увеличивается на доли миллиметра, а длина – на 2–3 мм.
Аккумуляторные батареи всегда собираются из незащищенных элементов, а затем оснащаются платой защиты. Она выбирается в зависимости от схемы сборки батареи и необходимых функций. Контроллеры для Li-ion батарей бывают с балансировкой и без нее, разного функционала, рассчитанные на определенные рабочие характеристики и разное количество последовательно соединенных элементов в сборке: 3S, 4S, …, 20S и т.д.
Как работает контроллер аккумулятора?
Принцип работы контроллера батареи заключается в поддержании рабочих параметров в допустимых диапазонах. BMS плата контролирует работу АКБ сразу по нескольким параметрам:
- По напряжению – она не допускает критического снижения напряжения (глубокого разряда аккумуляторов) и перезаряда аккумуляторов. Когда напряжение достигает критического минимума или максимума, контроллер отключает батарею от нагрузки или зарядного устройства. Для большинства литий-ионных аккумуляторов рабочее напряжение должно поддерживаться в диапазоне от 2,5 В в разряженном состоянии до 4,25 В в заряженном.
 В зависимости от типа аккумулятора, эти значения могут быть другими. В любом случае задача BMS платы – не допустить выхода напряжения за границы, установленные для конкретного типа АКБ. Тем самым контроллер оберегает элементы питания от деградации, потери емкости, вздутия, перегрева, риска возгорания и взрыва.
В зависимости от типа аккумулятора, эти значения могут быть другими. В любом случае задача BMS платы – не допустить выхода напряжения за границы, установленные для конкретного типа АКБ. Тем самым контроллер оберегает элементы питания от деградации, потери емкости, вздутия, перегрева, риска возгорания и взрыва. - По току – контроллер отключает АКБ от нагрузки, если ток разряда превышает допустимые значения. Уровень токоотдачи у разных Li-ion аккумуляторов может составлять от 1С до 25С. И если в условиях, где нужны высокотоковые аккумуляторы, использовать обычные модели, они быстро придут в негодность. Контроллер защиты не допустит этого и просто отключит АКБ, если она не рассчитана на такие нагрузки. Также он защищает аккумуляторы от короткого замыкания.
- По температуре – функция контроля температуры предусмотрена не во всех аккумуляторных контроллерах, но она важна для защиты АКБ от перегрева. Поэтому в схемы многофункциональных BMS плат обязательно входит терморезистор.

Некоторые BMS платы кроме основных функций умеют выполнять балансировку ячеек в аккумуляторной батарее – выравнивать напряжение всех аккумуляторов в сборке. Это помогает избежать несоответствий по уровню заряда и продлить срок службы батареи.
Причины блокировки аккумулятора контроллером
Если контроллер блокирует работу аккумулятора, причина может заключаться в следующем:
- короткое замыкание внутри элемента питания;
- глубокий разряд – критическое падение напряжения на ячейках.
Разрядившуюся батарею нужно скорее поставить на зарядку. Если же хранить ее в таком состоянии, дальнейший саморазряд приведет к полному разряду, и зарядить АКБ не получится. Контроллер в целях безопасности просто не позволит запустить процесс зарядки.
Это объясняется тем, что при хранении разряженных аккумуляторов в их структуре происходят необратимые процессы деградации, образуются кристаллы лития, возникает опасный контакт между полюсами и опасность взрыва. Задача контроллера – не допустить подобных последствий, поэтому он блокирует дальнейшее использование аккумуляторов с напряжением, упавшим ниже критического минимума.
Задача контроллера – не допустить подобных последствий, поэтому он блокирует дальнейшее использование аккумуляторов с напряжением, упавшим ниже критического минимума.
Предыдущая статья блога VirtusTec посвящена литиевым АКБ для погрузчиков, штабелеров, и других видов складской техники.
2021-05-19
Комментарии: 0
Просмотры: 3119
Комментарии
Принцип работы свинцово-кислотного аккумулятора.
Принцип работы свинцового аккумулятора
Источником электроэнергии на автомобиле при неработающем или работающем с малой частотой вращения коленчатого вала двигателе является аккумуляторная батарея. В настоящее время на автомобилях наиболее широко применяются свинцовые аккумуляторные батареи, состоящие из нескольких последовательно соединенных аккумуляторов. Применение кислотных аккумуляторов объясняется тем, что они обладают небольшим внутренним сопротивлением и способны в течение короткого промежутка времени (несколько секунд) отдавать ток силой в несколько сотен ампер, что необходимо для питания стартера при пуске двигателя.
Применение кислотных аккумуляторов объясняется тем, что они обладают небольшим внутренним сопротивлением и способны в течение короткого промежутка времени (несколько секунд) отдавать ток силой в несколько сотен ампер, что необходимо для питания стартера при пуске двигателя.
Свинцовый аккумулятор электрической энергии был изобретен в 1859 году французским физиком Гастоном Планте. В последующие годы конструкция аккумулятора, особенно – химический состав его электродов (пластин) постоянно совершенствовалась. В настоящее время свинцовые аккумуляторы и аккумуляторные батареи широко применяются в разных областях техники в качестве накопителей электроэнергии (стартерные батареи, аварийные и резервные источники энергии и т. п.).
Конструктивно аккумулятор представляет собой емкость, наполненную электролитом, в которой размещены свинцовые электроды. В качестве электролита используется раствор серной кислоты и дистиллированной воды. Электроды выполнены в виде пластин, одна из которых изготовлена из губчатого свинца Pb, а вторая – из диоксида свинца PbO2.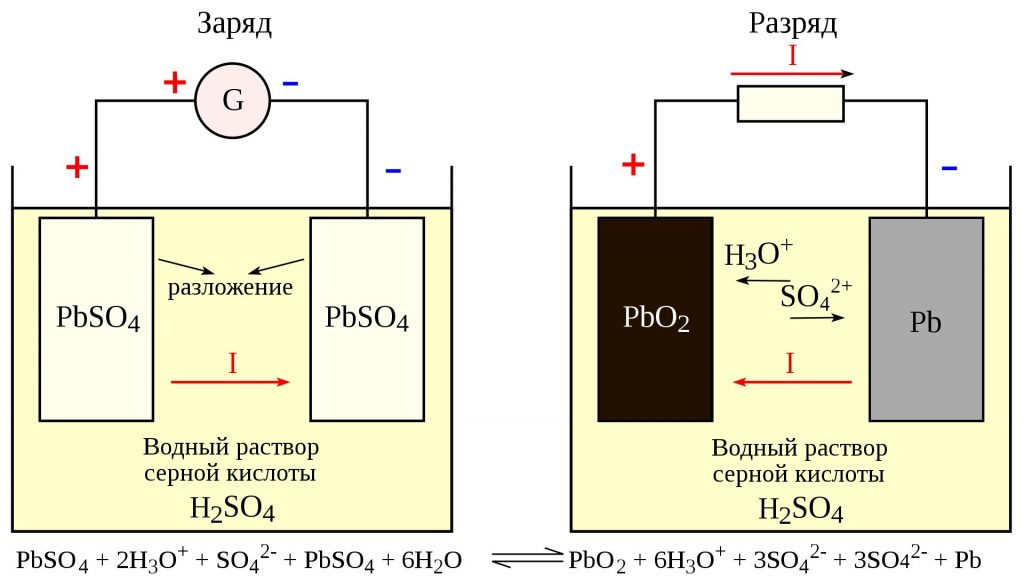 При взаимодействии электродов с электролитом между ними возникает разность потенциалов.
При взаимодействии электродов с электролитом между ними возникает разность потенциалов.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца.
Во время разряда происходит восстановление диоксида свинца на положительном электроде (аноде) и окисление свинца на отрицательном электроде (катоде). При пропускании через электроды аккумулятора зарядного тока в нем протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
Реакции на аноде:
PbO2 + SO42- + 4H+ + 2e— ↔ PbSO4 + 2H2O;
Реакции на катоде:
Pb + SO42- — 2e— ↔ PbSO4.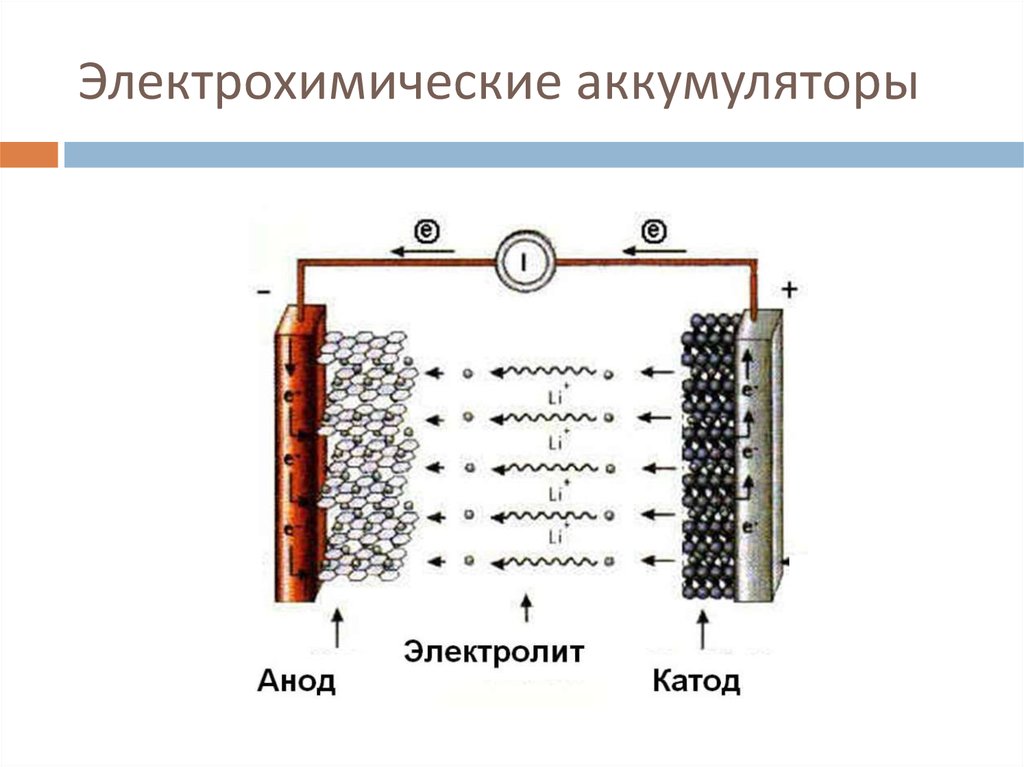
Физические процессы, происходящие в аккумуляторе, объясняются свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор. Легкоокисляющиеся металлы (например, свинец) обладают этим свойством в большей степени, чем инертные металлы.
При погружении свинцового электрода в раствор электролита от него начнут отделяться положительно заряженные ионы свинца и переходить в раствор, при этом сам электрод будет заряжаться отрицательно.
По мере протекания процесса растет разность потенциалов раствора и электрода, и переход положительных ионов в раствор будет замедляться.
При какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца, с одной стороны, и силами электростатического поля и осмотического давления — с другой.
В результате переход ионов свинца в электролит прекратится.
При погружении электрода, изготовленного из двуокиси свинца, в раствор серной кислоты наблюдается такой же процесс, но результат получается иной. Двуокись свинца в ограниченном количестве переходит в раствор, где при соединении с водой ионизируется на четырехвалентные ионы свинца Рв4+ и одновалентные ионы гидроксила ОН.
Двуокись свинца в ограниченном количестве переходит в раствор, где при соединении с водой ионизируется на четырехвалентные ионы свинца Рв4+ и одновалентные ионы гидроксила ОН.
Четырехвалентные ионы свинца, осаждаясь на электроде, создают положительный потенциал относительно раствора. Серная кислота образует в воде практически только на ионы НO+ и HSO4.
Таким образом, при разряде аккумулятора расходуется серная кислота, образуется вода, а на обоих электродах — сульфат свинца. При заряде процессы протекают в обратном направлении.
При подключении потребителей в аккумуляторе возникает разрядный ток. При этом ионы сернокислотного остатка SO4 соединяются со свинцом электродов и образуют на них сернокислый свинец PbSO4, а ионы водорода соединяются с кислородом, выделяясь на положительной пластине в виде воды.
В результате электроды покрываются сернокислым свинцом, а серная кислота разбавляется водой, т.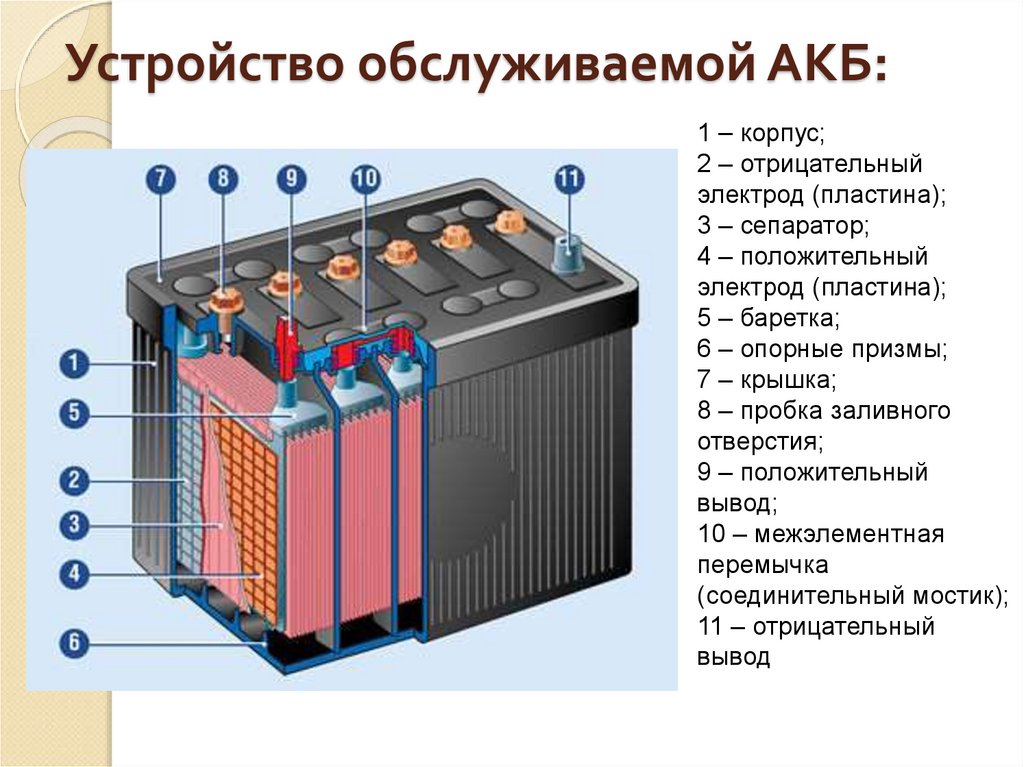 е. при разряде аккумулятора плотность электролита уменьшается. Поэтому по плотности электролита можно судить о степени заряженности аккумуляторной батареи.
е. при разряде аккумулятора плотность электролита уменьшается. Поэтому по плотности электролита можно судить о степени заряженности аккумуляторной батареи.
При прохождении электрического (зарядного) тока через аккумуляторную батарею протекают обратные электрохимические процессы. Ионы водорода, образующиеся в результате распада воды, взаимодействуют с сернокислым свинцом электродов.
Водород, соединяясь с сернистым осадком, образует серную кислоту, а на электродах восстанавливается губчатый свинец. Выделяющийся из воды кислород, соединяется со свинцом положительной пластины, образуя перекись свинца.
В результате этих процессов содержание воды в электролите уменьшается, а содержание кислоты увеличивается, что приводит к повышению плотности электролита.
По завершению процессов восстановления свинца на электродах заряд аккумулятора прекращается. При дальнейшем прохождении электрического тока через электролит начинается процесс электролиза (разложения) воды, при этом аккумулятор «закипает», и выделяющиеся пузырьки образуют смесь водорода и кислорода. Смесь этих газов является взрывоопасной, поэтому следует избегать перезаряда до появления электролизных явлений по разложению воды.
Смесь этих газов является взрывоопасной, поэтому следует избегать перезаряда до появления электролизных явлений по разложению воды.
Кроме того, длительный перезаряд приводит к потере электролитом воды (испарению), в результате чего его плотность повышается и для корректировки требуется доливка дистиллированной воды.
При доливке воды необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли, что при попадании на открытое тело или одежду может привести к ожогам кожи, слизистых оболочек, прожигу одежды и другим неприятным последствиям.
При постоянном напряжении источника зарядного тока по мере увеличения степени заряженности аккумулятора повышается его ЭДС и, следовательно, уменьшается сила зарядного тока. Когда напряжение на клеммах источника тока будет равно ЭДС полностью заряженного аккумулятора плюс ЭДС поляризации, зарядный ток прекратится.
Среднее значение напряжения аккумулятора – 2 В. Поскольку электрооборудование современных автомобилей рассчитано для работы при напряжении в бортовой сети 12 или 24 В, аккумуляторы соединяют в батареи (по 6 или 12 шт.).
Поскольку электрооборудование современных автомобилей рассчитано для работы при напряжении в бортовой сети 12 или 24 В, аккумуляторы соединяют в батареи (по 6 или 12 шт.).
Важным параметром аккумулятора является его емкость, т. е. количество электрической энергии, которую способен отдать аккумулятор. Емкость – это произведение силы разрядного тока на продолжительность разрядки до предельно допустимого разряженного состояния. Измеряется емкость аккумулятора в ампер-часах (А×ч). Емкость аккумулятора зависит, в первую очередь, от активной площади его электродов.
Поэтому повышения емкости можно достичь увеличением поверхности электродов, что достигается использованием нескольких параллельно соединенных между собой пластин, а также применением пористого материала для их изготовления, что позволяет использовать в качестве активной массы не только поверхность, но и внутренний объем пластин.
Емкость аккумулятора не постоянна, она зависит от силы разрядного тока, температуры электролита и состояния активной поверхности пластин.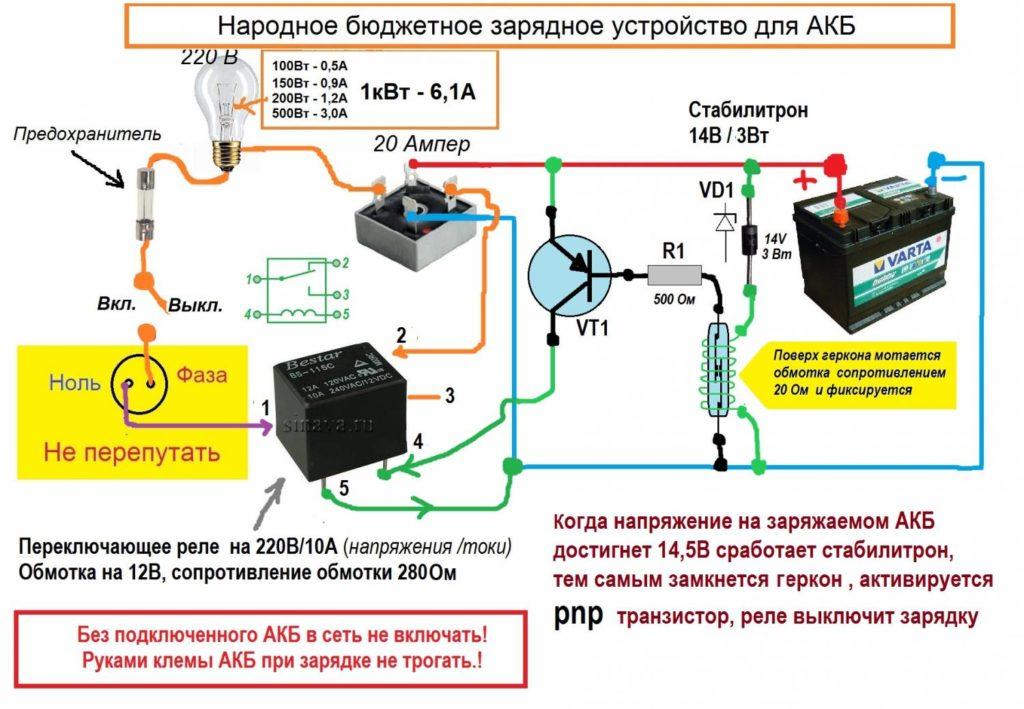 При увеличении разрядного тока и понижении температуры электролита емкость аккумулятора уменьшается, что объясняется неполным протеканием электрохимических реакций разрядки в этих условиях, вследствие сокращения времени разрядки и повышения вязкости электролита при низких температурах.
При увеличении разрядного тока и понижении температуры электролита емкость аккумулятора уменьшается, что объясняется неполным протеканием электрохимических реакций разрядки в этих условиях, вследствие сокращения времени разрядки и повышения вязкости электролита при низких температурах.
***
Устройство аккумуляторной батареи и ее маркировка
Главная страница
- Страничка абитуриента
Дистанционное образование
- Группа ТО-81
- Группа М-81
- Группа ТО-71
Специальности
- Ветеринария
- Механизация сельского хозяйства
- Коммерция
- Техническое обслуживание и ремонт автотранспорта
Учебные дисциплины
- Инженерная графика
- МДК.01.01. «Устройство автомобилей»
- Карта раздела
- Общее устройство автомобиля
- Автомобильный двигатель
- Трансмиссия автомобиля
- Рулевое управление
- Тормозная система
- Подвеска
- Колеса
- Кузов
- Электрооборудование автомобиля
- Основы теории автомобиля
- Основы технической диагностики
- Основы гидравлики и теплотехники
- Метрология и стандартизация
- Сельскохозяйственные машины
- Основы агрономии
- Перевозка опасных грузов
- Материаловедение
- Менеджмент
- Техническая механика
- Советы дипломнику
Олимпиады и тесты
- «Инженерная графика»
- «Техническая механика»
- «Двигатель и его системы»
- «Шасси автомобиля»
- «Электрооборудование автомобиля»
Принцип работы свинцово-кислотных и литий-ионных аккумуляторов —
Свинцово-кислотные и литиевые аккумуляторы в настоящее время широко используются в быту. Давайте посмотрим на принципы работы свинцово-кислотных аккумуляторов и литиевых аккумуляторов.
Давайте посмотрим на принципы работы свинцово-кислотных аккумуляторов и литиевых аккумуляторов.
Как работает свинцово-кислотный аккумулятор
Когда серная кислота растворяется, ее молекулы распадаются на положительные ионы водорода (2H+) и сульфатные отрицательные ионы (SO4—) и свободно перемещаются. Если два электрода погружены в растворы и подключены к источнику постоянного тока, то ионы водорода заряжаются положительно и перемещаются к электродам и подключаются к отрицательной клемме источника питания. Отрицательно заряженные ионы SO4- перемещались к электродам, подключенным к положительной клемме питающей сети (т. е. к аноду).
Каждый ион водорода забирает один электрон с катода, а каждый сульфат-ион забирает два отрицательных иона с анода и вступает в реакцию с водой, образуя серную и водородную кислоты.
Кислород, полученный в результате приведенного выше уравнения, реагирует с оксидом свинца и образует пероксид свинца (PbO2). Таким образом, во время зарядки свинцово-кислотных аккумуляторов свинец-катод остается свинцом, а свинцовый анод превращается в пероксид свинца шоколадного цвета.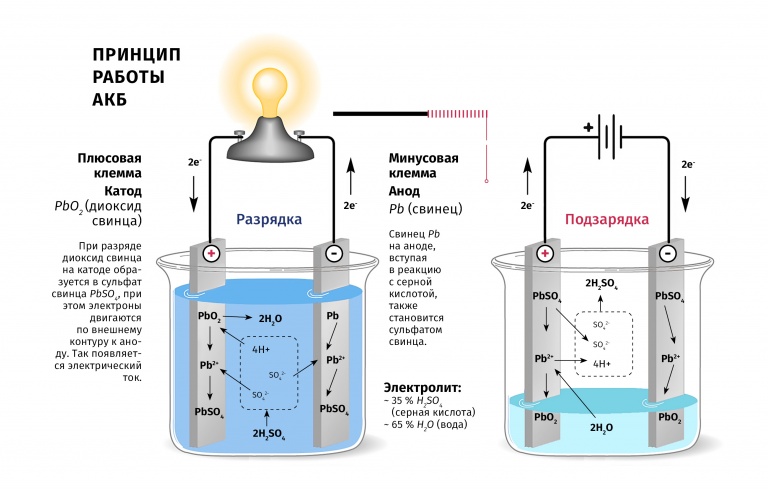 .
.
Если источник постоянного тока отключен и вольтметр подключен между электродами, он покажет разность потенциалов между ними. Если провод соединяет электроды, то ток будет течь от положительной пластины к отрицательной через внешнюю цепь, т.е. ячейка способна поставлять электрическую энергию.
Химическое действие во время разрядки
Когда элемент полностью разряжен, анод изготавливается из перекиси свинца (PbO2), а катод из металлического губчатого свинца (Pb). Когда электроды соединены через сопротивление, ячейка разряжается, и электроны текут в направлении, противоположном тому, что происходит во время зарядки.
Ионы водорода движутся к аноду и, достигая анодов, получают один электрон от анода и становятся атомом водорода. Атом водорода вступает в контакт с PbO2, поэтому он атакует и образует сульфат свинца (PbSO4), беловатого цвета и воду согласно химическому уравнению.
Каждый ион сульфата (SO4—) движется к катоду и, достигая там, отдает два электрона, становится радикалом SO4, атакует катод из металлического свинца и образует сульфат свинца беловатого цвета в соответствии с химическим уравнением.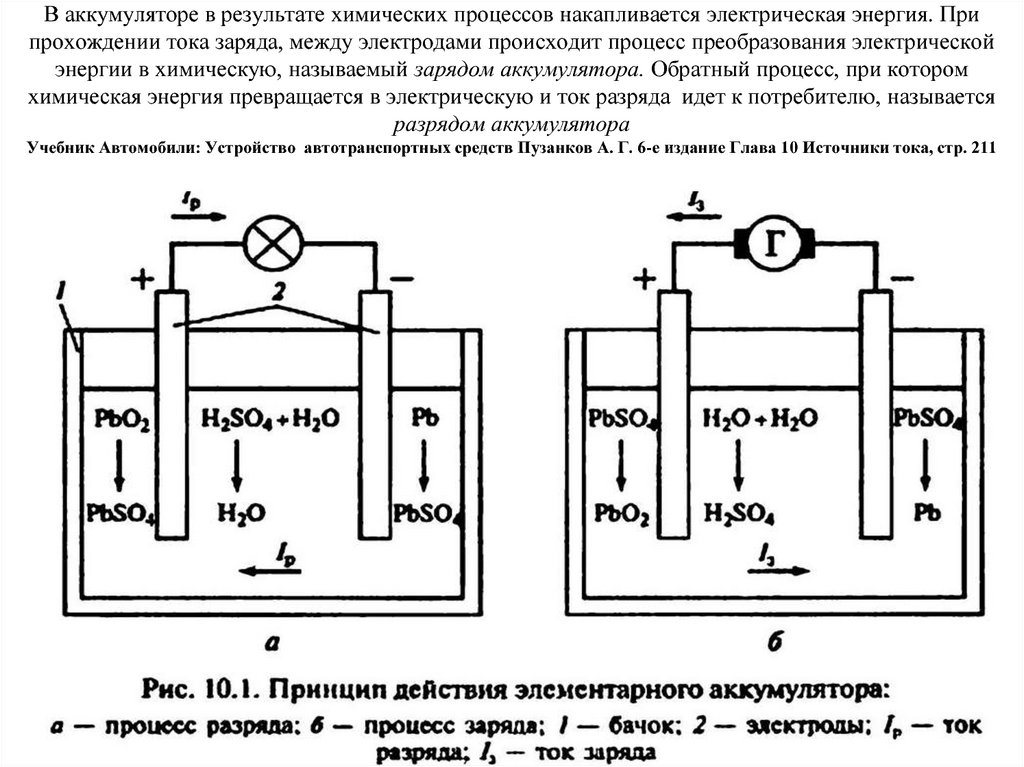
Химическое действие во время перезарядки
Для перезарядки анод и катод подключаются к положительной и отрицательной клемме сети постоянного тока. Молекулы серной кислоты распадаются на ионы 2Н+ и SO4—. Ионы водорода, будучи положительно заряженными, движутся к катодам, получают оттуда два электрона и образуют атом водорода. Атом водорода реагирует с катодом сульфата свинца с образованием свинца и серной кислоты в соответствии с химическим уравнением.
SO4— ион движется к аноду, отдает два дополнительных электрона, становится радикалом SO4, реагирует с анодом из сульфата свинца и образует пероксид свинца и серную кислоту в соответствии с химическим уравнением.
Зарядка и разрядка представлены одним обратимым уравнением, приведенным ниже.
Уравнение должно читаться вниз для разряда и вверх для перезарядки.
Химия литий-ионных аккумуляторов
Как следует из названия, ионы лития (Li+) участвуют в реакциях, приводящих в действие аккумулятор. Оба электрода в литий-ионном элементе изготовлены из материалов, которые могут интеркалировать или «поглощать» ионы лития (немного похоже на гидрид-ионы в NiMH-батареях). Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионного аккумулятора ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Оба электрода в литий-ионном элементе изготовлены из материалов, которые могут интеркалировать или «поглощать» ионы лития (немного похоже на гидрид-ионы в NiMH-батареях). Интеркаляция — это когда заряженные ионы элемента могут «удерживаться» внутри структуры материала-хозяина, не нарушая ее существенно. В случае литий-ионного аккумулятора ионы лития «привязаны» к электрону внутри структуры анода. Когда батарея разряжается, интеркалированные ионы лития высвобождаются из анода, а затем проходят через раствор электролита, чтобы поглощаться (интеркалироваться) катодом.
Литий-ионный аккумулятор начинает свою жизнь в состоянии полной разрядки: все его ионы лития интеркалированы внутри катода, а его химический состав еще не способен производить электричество. Прежде чем вы сможете использовать аккумулятор, его необходимо зарядить. Когда аккумулятор заряжается, на катоде происходит реакция окисления, а это означает, что он теряет часть отрицательно заряженных электронов. Для поддержания баланса зарядов на катоде в раствор электролита растворяют равное количество положительно заряженных интеркалированных ионов лития. Они перемещаются к аноду, где внедряются в графит. Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Они перемещаются к аноду, где внедряются в графит. Эта реакция интеркаляции также откладывает электроны в графитовый анод, чтобы «связать» ион лития.
Во время разряда ионы лития деинтеркалируются с анода и возвращаются через электролит к катоду. Это также высвобождает электроны, которые привязывали их к аноду, и они текут по внешнему проводу, обеспечивая электрический ток, который мы использовали для выполнения работы. Именно соединение внешнего провода позволяет протекать реакции — когда электроны могут свободно перемещаться, то и положительно заряженные ионы лития уравновешивают движение своего отрицательного заряда.
Когда катод заполняется ионами лития, реакция прекращается и батарея разряжается. Затем мы снова перезаряжаем наши литий-ионные батареи, и внешний электрический заряд, который мы прикладываем, выталкивает ионы лития обратно в анод от катода.
Электролит в литий-ионном элементе обычно представляет собой раствор солей лития в смеси растворителей (таких как диметилкарбонат или диэтилкарбонат), разработанный для улучшения характеристик аккумулятора. Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (интеркалироваться) катодом. Обратное происходит во время перезарядки.
Наличие солей лития, растворенных в электролите, означает, что раствор содержит ионы лития. Это означает, что отдельные ионы лития не должны совершать полный путь от анода к катоду, чтобы замкнуть цепь. По мере того как ионы выбиваются из анода, другие, которые уже находятся в электролите, вблизи поверхности электрода, могут легко поглощаться (интеркалироваться) катодом. Обратное происходит во время перезарядки.
Будучи маленьким и легким, большое количество лития может храниться (интеркалироваться) в обоих электродах. Поэтому литиевые батареи часто используются в ховер-картах. Именно это придает литий-ионным батареям высокую плотность энергии. Например, один ион лития может храниться на каждые шесть атомов углерода в графите, и чем больше ионов лития участвует в путешествии от анода к катоду (и обратно во время циклов перезарядки), тем больше электронов остается на пути. уравновешивают их движение и обеспечивают электрический ток.
Перенос ионов лития между электродами происходит при гораздо более высоком напряжении, чем в других типах аккумуляторов, и, поскольку они должны быть уравновешены равным количеством электронов, один литий-ионный элемент может производить напряжение 3,6 вольта или выше. , в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
, в зависимости от материалов катода. Типичный щелочной элемент выдает всего около 1,5 вольт. Для стандартного свинцово-кислотного автомобильного аккумулятора требуется шесть 2-вольтовых элементов, соединенных вместе, чтобы получить 12 вольт.
Из-за их высокой плотности энергии и относительной легкости установка большого количества литий-ионных элементов в одном месте позволяет получить аккумуляторный блок, который намного легче и компактнее, чем стек из других типов аккумуляторов. Если мы сложим вместе достаточное количество литий-ионных элементов, мы сможем достичь довольно высокого напряжения, например, необходимого для запуска электромобиля. Конечно, во всех наших автомобилях уже есть аккумуляторы, но они нужны только для того, чтобы запустить бензиновый или дизельный двигатель, тогда всю работу делает топливо. Аккумулятор электромобиля — это его источник энергии и то, что дает ему возможность подняться на крутой холм. Таким образом, он обычно будет иметь 96 вольт или даже больше, что даже при высоком напряжении литий-ионного элемента требует довольно много элементов, сложенных вместе.
Анод обычно графитовый. Однако многократное введение ионов лития в стандартную графитовую структуру типичной литий-ионной батареи в конечном итоге разрушает графит. Это снижает производительность батареи, и графитовый анод в конечном итоге сломается, и батарея перестанет работать. Исследователи работают над разработкой вариантов использования графена (листов углерода толщиной в один атом) вместо графита. Вы узнаете больше о графене и о том, чем он хорош, в следующей теме Nova.
Что касается материала, из которого изготавливается катод, существует довольно много вариаций — обычно из комбинации лития, кислорода и какого-либо металла.
Благодаря их принципам работы мы можем понять, что свинцово-кислотные батареи на самом деле более экологичны, чем литиевые батареи.
Поделиться
Как работает автомобильный аккумулятор
Автомобильный свинцово-кислотный аккумулятор на 12 В. Эти большие и довольно тяжелые батареи используются в каждом автомобиле с двигателем внутреннего сгорания на планете. Они являются неотъемлемой частью автомобиля. Так что же он делает и как он работает? Об этом мы расскажем в этой статье, спонсируемой Squarespace. Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
Они являются неотъемлемой частью автомобиля. Так что же он делает и как он работает? Об этом мы расскажем в этой статье, спонсируемой Squarespace. Перейдите на сайт sqarespace.com, чтобы начать бесплатную пробную версию, или используйте инженерное мышление, чтобы сэкономить 10 % на веб-сайтах и доменах.
Прокрутите вниз, чтобы посмотреть обучающее видео на YouTube.
Что такое автомобильный аккумулятор?
Свинцово-кислотный аккумулятор
Автомобильный аккумулятор на 12 В выглядит примерно так.
Это свинцово-кислотный аккумулятор. Мы называем это свинцово-кислотным аккумулятором, потому что внутри устройства находятся свинцовые пластины, погруженные в кислоту. Это создает химическую реакцию, которая высвобождает энергию и обеспечивает нас напряжением и током.
Химическая реакция
Таким образом, батарея накапливает энергию в виде химической энергии. Он не хранит электричество. Эта химическая энергия преобразуется в электрическую энергию всякий раз, когда она нам нужна. Эта батарея также является перезаряжаемой, если мы снабдим батарею электричеством, мы сможем обратить химическую реакцию вспять и перезарядить батарею.
Эта батарея также является перезаряжаемой, если мы снабдим батарею электричеством, мы сможем обратить химическую реакцию вспять и перезарядить батарею.
Зарядка от генератора
Батареи этих типов могут обеспечивать большой ток, особенно по сравнению с типичными, меньшими по размеру, бытовыми щелочными батареями.
Мы рассмотрели, как работают щелочные батареи в нашей предыдущей статье, проверьте это ЗДЕСЬ.
Почему в автомобиле используется аккумулятор?
Типичный автомобильный аккумулятор находится в моторном отсеке автомобиля. Аккумулятор сначала используется для запуска двигателя, и он делает это, обеспечивая электричеством небольшой электрический двигатель, известный как стартер. Он также подает электричество в систему зажигания, чтобы начать сгорание топлива.
Стартер зацепляет небольшую шестерню на маховике двигателя. Это поворачивает коленчатый вал, который запускает двигатель внутреннего сгорания, затем маленькая шестерня отключается, и двигатель работает сам по себе.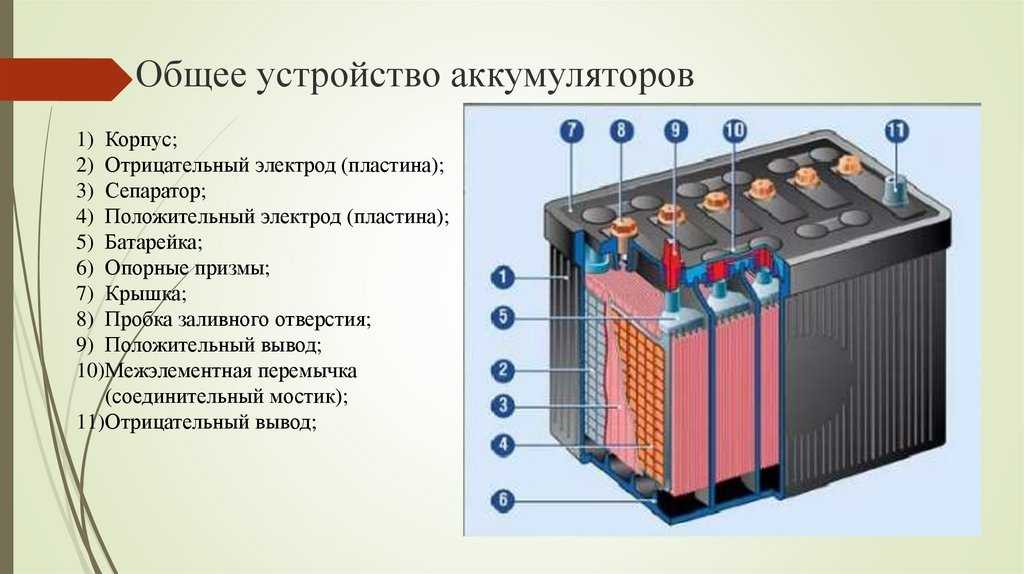 Стартер должен обеспечивать огромное усилие, чтобы иметь возможность вращать маховик, поэтому стартер потребляет чрезвычайно большой ток, возможно, сотни ампер, но только в течение нескольких секунд. Этот большой ток уменьшит энергию, хранящуюся в батарее. Так что нам нужно пополнить его обратно.
Стартер должен обеспечивать огромное усилие, чтобы иметь возможность вращать маховик, поэтому стартер потребляет чрезвычайно большой ток, возможно, сотни ампер, но только в течение нескольких секунд. Этот большой ток уменьшит энергию, хранящуюся в батарее. Так что нам нужно пополнить его обратно.
Стартер
К двигателю подключен генератор переменного тока. Генератор вращается двигателем и при вращении вырабатывает электричество. Это подается обратно в аккумулятор для его перезарядки.
Генератор
Когда двигатель работает, генератор заряжает аккумулятор, а также обеспечивает электроэнергией такие вещи, как освещение и музыкальная система. Когда спрос на электроэнергию превышает то, что может обеспечить генератор переменного тока, батарея обеспечивает дополнительную мощность, что снова разряжает батарею.
Если двигатель выключен, генератор переменного тока перестает вращаться и заряжать аккумулятор, поэтому аккумулятор будет обеспечивать полную мощность, пока не разрядится.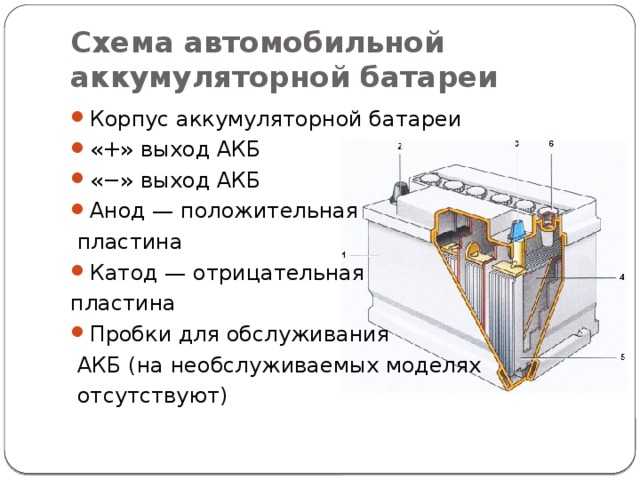 В этот момент батарея не может обеспечить достаточное количество электроэнергии для запуска двигателя, поэтому нам нужно запустить машину от внешнего источника.
В этот момент батарея не может обеспечить достаточное количество электроэнергии для запуска двигателя, поэтому нам нужно запустить машину от внешнего источника.
Основные части
Давайте посмотрим на основные части автомобильного аккумулятора, а затем поймем, как он работает.
Во-первых, у нас есть пластиковый корпус, в котором все внутренние компоненты находятся на своих местах. Сверху у нас есть пластиковая крышка и две клеммы, положительная и отрицательная, которые называются клеммными колодками.
Сняв крышку, мы можем заглянуть внутрь. Обратите внимание, что корпус разделен на 6 отдельных камер, каждая из которых разделена пластиковой стенкой. Каждая камера известна как ячейка. Каждая ячейка генерирует около 2,1 вольт постоянного или постоянного тока. Каждая ячейка соединена последовательно, минус одной ячейки соединен с плюсом следующей ячейки, чтобы получить общее напряжение около 12,6 В.
6 отдельных камер
Это то же самое, как если бы вы соединили бытовые щелочные батареи вместе, их напряжения суммируются, чтобы обеспечить более высокое общее напряжение.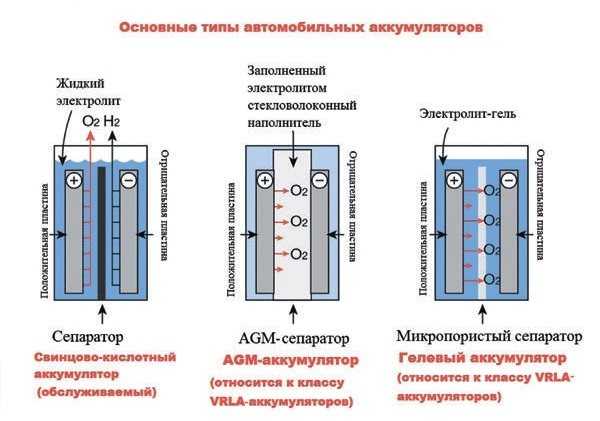
Каждая ячейка в батарее соединена с помощью пластины, сделанной из свинца. Они сварены вместе через пластиковую стенку, чтобы сформировать соединение.
Глядя на аккумулятор с этой точки зрения, мы видим, что ток течет через элементы аккумулятора от плюса к минусу, и это с использованием традиционной теории тока. На самом деле происходит то, что электроны текут в противоположном направлении от отрицательного к положительному. Но об этом чуть позже в статье.
Обратите внимание, что в каждой ячейке есть две пластины. Один положительный и один отрицательный. Их называют пластинчатыми ремнями, потому что каждый ремень соединен с рядом пластин, которые представляют собой листы свинца.
Пластины сформированы в виде решетчатых структур, которые максимально увеличивают площадь поверхности. Решетки покрыты пастой из оксида свинца. В пасте происходит химическая реакция, и мы увидим это чуть позже в статье. Паста действует как губка и впитывает часть жидкого электролита, что улучшает работу аккумулятора.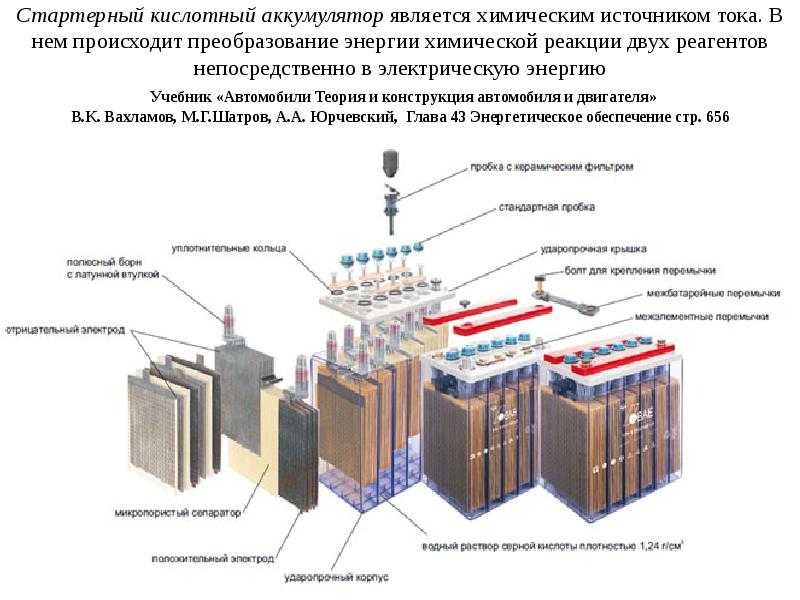 Размер пластины определяет, какой ток может обеспечить батарея, но не меняет напряжение. Используемые материалы и количество пластин определяют напряжение, создаваемое каждой ячейкой. Сетка удерживает пасту на месте, обеспечивая равномерное распределение тока по пластине и помогает транспортировать электроны из батареи по электрической цепи.
Размер пластины определяет, какой ток может обеспечить батарея, но не меняет напряжение. Используемые материалы и количество пластин определяют напряжение, создаваемое каждой ячейкой. Сетка удерживает пасту на месте, обеспечивая равномерное распределение тока по пластине и помогает транспортировать электроны из батареи по электрической цепи.
Отрицательная пластина является анодом и представляет собой пластину из чистого свинца, хотя в нее добавляют небольшое количество добавок для упрочнения свинца и защиты от коррозии. Положительная пластина является катодом и сделана из оксида свинца. Пластины сделаны из разнородных материалов, чтобы образовалась химическая реакция и высвободились электроны. Мы не хотим, чтобы положительные и отрицательные пластины соприкасались друг с другом, это приведет к короткому замыканию батареи. Поэтому вместо этого мы помещаем каждую положительную пластину в разделитель конвертов. Это пористый материал, который позволяет ионам проходить без прямого контакта материалов друг с другом.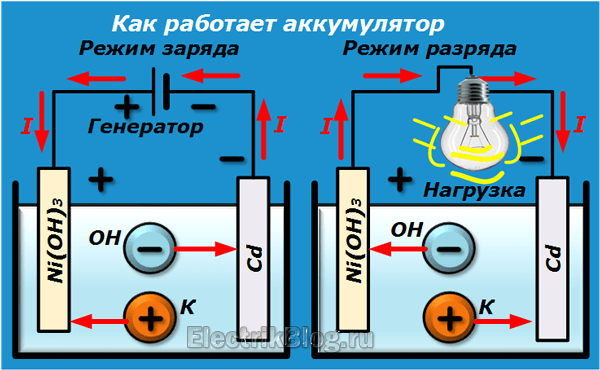
Положительная пластина
Положительная и отрицательная пластины расположены между собой с небольшим зазором между ними. Затем камера заполняется жидким электролитом из серной кислоты и воды. Поэтому батарея называется свинцово-кислотной.
Положительные и отрицательные
Основы электричества
Мы хотим быстро повторить основы электричества, чтобы вы поняли следующую часть того, как работает батарея.
Электроны
Электричество — это поток электронов в цепи. Нам нужно, чтобы много электронов текло в одном направлении по проводу, чтобы мы могли размещать предметы на пути электронов, например лампочки. Электроны должны будут пройти через него, и при этом они излучают свет. Когда много электронов течет в одном направлении, мы называем это током.
Атомы
Каждый материал состоит из атомов. Атомы имеют разное количество протонов, нейтронов и электронов, что и отличает материал. Некоторые материалы, такие как медь, имеют электрон, который может свободно перемещаться к другим атомам.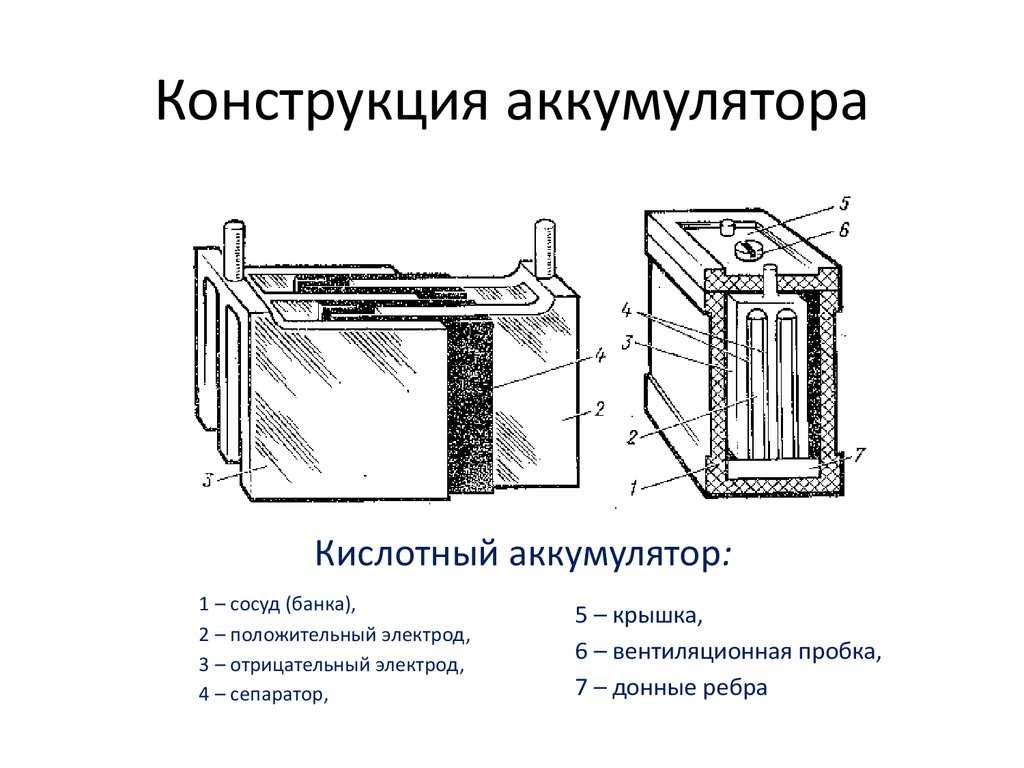 Если мы подключим источник питания, такой как батарея, к медному проводу, напряжение будет толкать электроны, и они устремятся к положительной клемме батареи.
Если мы подключим источник питания, такой как батарея, к медному проводу, напряжение будет толкать электроны, и они устремятся к положительной клемме батареи.
Мы сказали, что электроны текут от минуса к плюсу. Это известно как поток электронов, это теория того, как работает электричество, и это то, что происходит на самом деле. Но, возможно, вы привыкли видеть обычный ток, который идет от положительного к отрицательному, это исходная теория, известная как обычный ток. Это было доказано Джозефом Томпсоном, который открыл электрон и обнаружил, что они перетекают от отрицательного к положительному.
Джозеф Томпсон
Однако мы и по сей день используем обычную теорию тока при проектировании электрических цепей. Если мы посмотрим на эту простую схему, мы всегда должны предполагать, что ток течет от плюса к минусу, но инженеры и ученые знают, что электроны на самом деле текут в противоположном направлении. Электрические формулы, которые мы используем, по-прежнему будут давать одни и те же ответы независимо от того, в каком направлении течет электричество, поэтому это не имеет большого значения.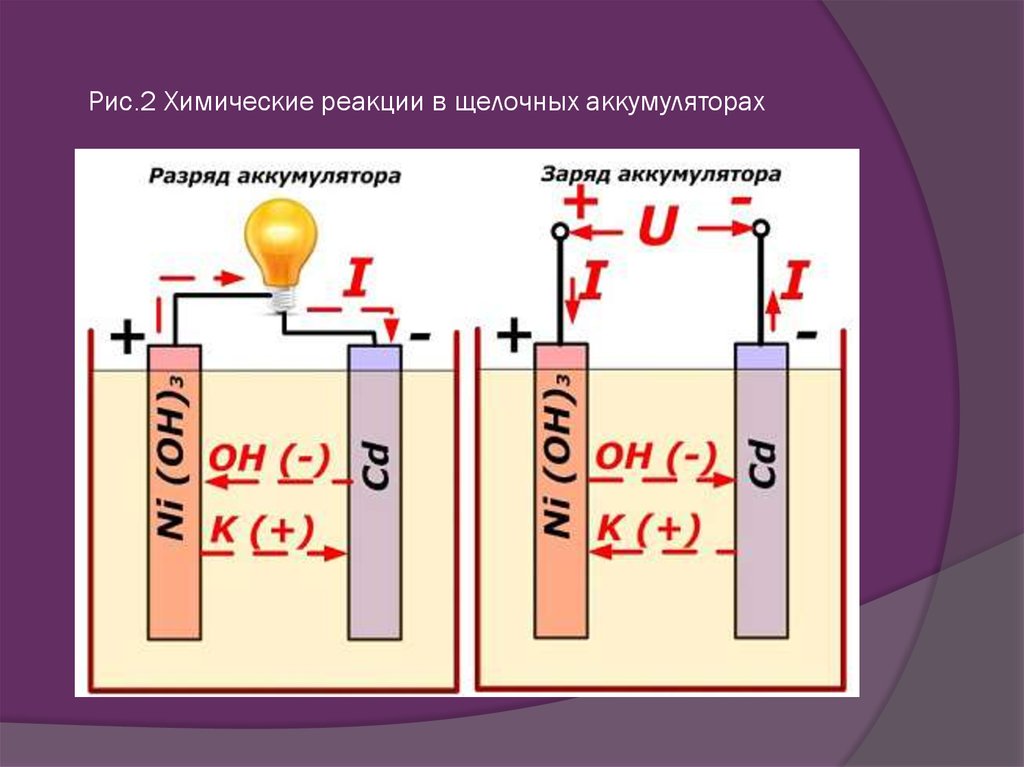
Постоянный ток
Существует два типа электричества: постоянный постоянный ток, который мы получаем от батарей. Электроны этого типа толкаются в одном направлении. Поэтому он называется постоянным током. Думайте об этом, как о воде, текущей по реке. Другой тип электричества — это переменный или переменный ток, который вы получаете от электрических розеток в своих домах. В этом типе электроны постоянно толкаются вперед и назад. Думайте об этом типе как о приливе и отливе моря.
Переменный ток
Когда мы смешиваем определенные материалы вместе, мы можем вызывать химические реакции. Это когда атомы одного материала взаимодействуют с атомами другого материала. Во время этого взаимодействия атомы будут соединяться или распадаться. Электроны также могут быть высвобождены или захвачены атомами во время реакции.
Химическая реакция
Когда мы говорим об атомах, вы обычно слышите термин «ион». Ион – это атом, который имеет неравное количество протонов или электронов. Атом имеет нейтральное изменение, когда в нем одинаковое количество протонов и электронов, потому что протоны изменены положительно, а электроны заряжены отрицательно, поэтому они уравновешиваются.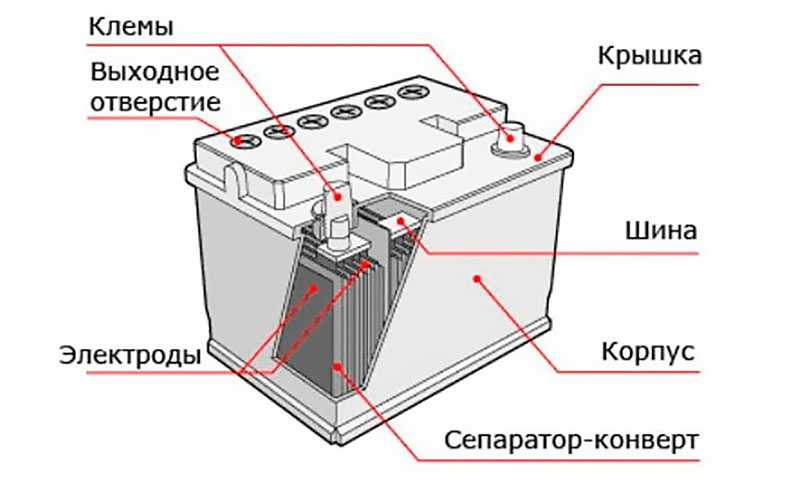 Если в атоме больше электронов, чем протонов, то это отрицательный ион. Если в атоме больше протонов, чем электронов, то это положительный ион.
Если в атоме больше электронов, чем протонов, то это отрицательный ион. Если в атоме больше протонов, чем электронов, то это положительный ион.
Ион
Как это работает
Вместо того, чтобы пытаться понять эту сложную конструкцию, мы упростим ее до этой простой модели элемента с одним катодом и одним анодом.
В этой ячейке находится жидкий электролит, который на 1/3 состоит из серной кислоты и на 2/3 из воды.
У нас есть положительный электрод, который является катодом, он сделан из оксида свинца (PbO 2 )
У нас есть положительный электрод, который является анодом, он сделан из чистого свинца (Pb)
Катод и анод
Когда эти материалы объединяются, мы получаем небольшую химическую реакцию между атомами. Мы покажем атомы этих материалов с помощью этих цветных сфер.
Положительная катодная клемма оксида свинца (PbO 2 ) будет реагировать с сульфатом (SO 4 -2 ) в электролите, при этом на катоде образуется слой сульфата свинца (PbSO4) Терминал. В ходе этой реакции ион кислорода (O 2 -2 ) выбрасывается из катода в электролит. Оказавшись в электролите, эти ионы кислорода объединятся с ионами водорода (H+) с образованием воды (H 2 O).
В ходе этой реакции ион кислорода (O 2 -2 ) выбрасывается из катода в электролит. Оказавшись в электролите, эти ионы кислорода объединятся с ионами водорода (H+) с образованием воды (H 2 O).
В то же время атомы свинца на аноде будут реагировать с ионами сульфата (SO 4 -2 ) в электролите. Эта реакция создаст слой сульфата свинца (PbSO 4 ) вокруг электрода. В ходе этой реакции высвобождаются два электрона, которые собираются на отрицательном полюсе.
Теперь у нас есть скопление электронов на отрицательной клемме. Поскольку электроны заряжены отрицательно, это означает, что у нас есть разница в заряде на двух клеммах, и мы можем измерить ее с помощью вольтметра или мультиметра.
Если вы думаете о магните, противоположные концы притягиваются, а одинаковые концы отталкиваются друг от друга. Электроны заряжены отрицательно, поэтому они отталкиваются друг от друга и притягиваются к положительной клемме, на которой меньше электронов.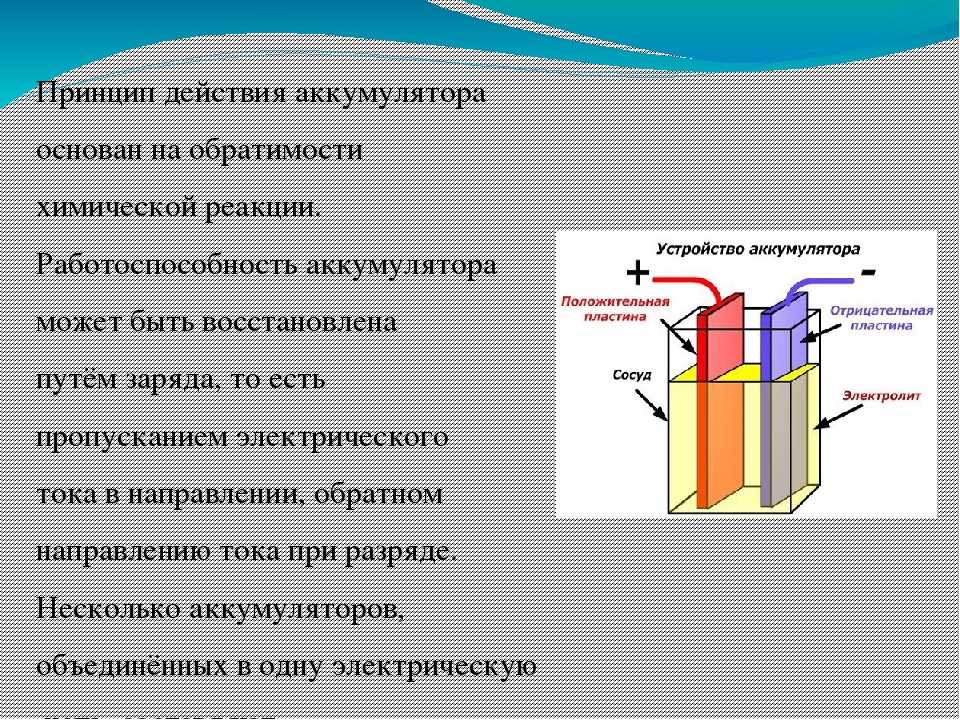 Но они не могут достичь этого. Если мы обеспечим путь для электронов, например провод, то электроны будут проходить через него, чтобы добраться до положительной клеммы. Затем мы можем поставить на пути этих электронов такие вещи, как лампа, и использовать их для выполнения работы, например, для освещения лампы.
Но они не могут достичь этого. Если мы обеспечим путь для электронов, например провод, то электроны будут проходить через него, чтобы добраться до положительной клеммы. Затем мы можем поставить на пути этих электронов такие вещи, как лампа, и использовать их для выполнения работы, например, для освещения лампы.
Пока путь существует, химическая реакция продолжается, но это не будет длиться вечно. Химические вещества, необходимые для реакции, закончатся. Кислота разбавляется и слабеет, а сульфат свинца покрывает оба электрода. Это означает, что материалы становятся более похожими, и химическую реакцию становится труднее достичь.
Но, к счастью, эту химическую реакцию можно обратить вспять, поэтому, если мы снабдим аккумулятор электричеством от генератора переменного тока, мы сможем начать обратную реакцию.
Возможна обратная реакция
Электроны входят в отрицательную клемму и воссоединяются с сульфатом свинца, высвобождая сульфат в электролит, оставляя только свинец на отрицательной пластине. Ионы сульфата входят в электролит и объединяются с ионом водорода, высвобождая ион кислорода, поэтому кислота электролита становится сильнее. Ион кислорода соединяется со свинцом, образуя оксид свинца, который высвобождает сульфат обратно в электролит, снова делая его прочнее.
Ионы сульфата входят в электролит и объединяются с ионом водорода, высвобождая ион кислорода, поэтому кислота электролита становится сильнее. Ион кислорода соединяется со свинцом, образуя оксид свинца, который высвобождает сульфат обратно в электролит, снова делая его прочнее.
Если бы мы оставляли аккумулятор полностью разряжаться слишком долго или слишком много раз, было бы очень трудно обратить химическую реакцию вспять. Кроме того, сульфатный слой может оторваться от электродов и акклиматизироваться на дне батареи, что означает, что он больше не участвует в химической реакции, поэтому батарею необходимо отремонтировать или заменить.
Итак, когда мы смотрим на аккумулятор, эта химическая реакция происходит между каждой пластиной в каждой ячейке, чтобы обеспечить ток в сотни ампер для запуска стартера, а также обеспечить напряжение для питания фар и т. д. Затем он перезаряжается генератор.
Проверка автомобильного аккумулятора с помощью мультиметра
Чтобы проверить напряжение автомобильного аккумулятора, мы просто переключаемся на настройку напряжения постоянного тока на нашем мультиметре, а затем подключаем красный провод к положительному, а черный провод к отрицательному. Мы должны увидеть напряжение около 12,6 В, если оно ниже 12, то батарея не работает должным образом.
Мы должны увидеть напряжение около 12,6 В, если оно ниже 12, то батарея не работает должным образом.
Двигатель выключен
Когда мы заводим автомобиль, напряжение падает, потому что стартер потребляет огромное количество тока. Напряжение упадет примерно до 11 вольт, если оно упадет ниже 10 вольт, то батарея не работает должным образом.
Запуск двигателя
Когда двигатель работает, генератор переменного тока должен вырабатывать электричество, поэтому мы должны увидеть более высокое напряжение около 14 вольт, потому что генератор перезаряжает аккумулятор, и напряжение должно быть выше, чтобы помочь вернуть электроны обратно. и обратить вспять химическую реакцию.
Engine Running
Но теперь, когда вы полностью заряжены, зайдите на сайт Squarespace.com, чтобы создать свое собственное веб-присутствие в Интернете, которое содержит множество функций, позволяющих людям запускать, делиться и продвигать свои собственные проекты.
Мощные инструменты для ведения блога, чтобы демонстрировать фотографии, видео и обновления ваших проектов.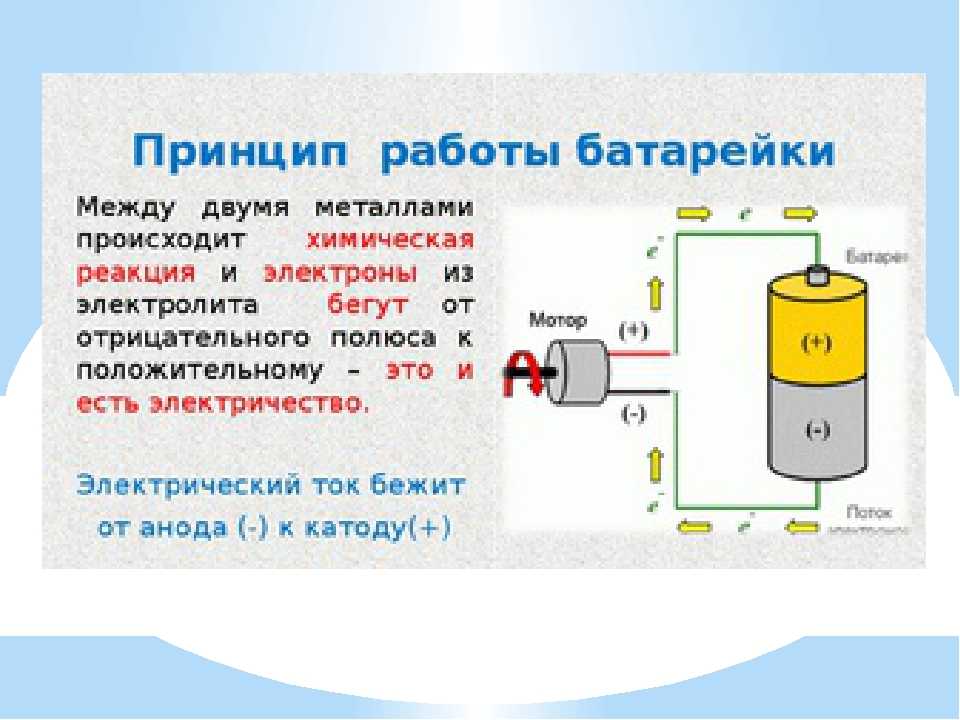
 В зависимости от типа аккумулятора, эти значения могут быть другими. В любом случае задача BMS платы – не допустить выхода напряжения за границы, установленные для конкретного типа АКБ. Тем самым контроллер оберегает элементы питания от деградации, потери емкости, вздутия, перегрева, риска возгорания и взрыва.
В зависимости от типа аккумулятора, эти значения могут быть другими. В любом случае задача BMS платы – не допустить выхода напряжения за границы, установленные для конкретного типа АКБ. Тем самым контроллер оберегает элементы питания от деградации, потери емкости, вздутия, перегрева, риска возгорания и взрыва.