Содержание
Справочные таблицы по автомобильным аккумуляторам, электролитам
Приведены полезные справочные таблицы по автомобильным аккумуляторам, электролитам, будут полезны для тех кто использует и обслуживает свинцовые аккумуляторные батареи.
Таблица 1. Удельное сопротивление электролита в зависимости от плотности и температуры.
| Температура, градусов С | Удельное сопротивление ом»см Минимальное удельное сопри плотности г/см3 противление, ом*см | ||||
| 1,105 | 1,184 | 1,265 | 1,353 | ||
| +30 | 1,596 | 1,180 | 1,140 | 1,312 | 1,129 (1,236) |
| +25 | 1,689 | 1,261 | 1,231 | 1,422 | 1,213 (1,233) |
| +20 | 1,800 | 1,357 | 1,334 | 1,549 | 1,310 (1,228) |
| +10 | 2,090 | 1,606 | 1,602 | 1,885 | 1,562 (1,222) |
| 0 | 2,510 | 1,961 | 1,998 | 2,371 | 1,928 (1,213) |
| -10 | — | 2,500 | 2,600 | 3,100 | 2,480 (1,206) |
| -20 | — | 3,350 | 3,570 | 4,310 | 3,340 (1,198) |
| -30 | — | — | 5,290 | 6,350 | — |
| -40 | — | — | 8,390 | 9,890 | — |
Примечание. В столбце Минимальное удельное сопротивление в скобках указана плотность электролита, имеющего минимальное сопротивление при данном значении температуры.
В столбце Минимальное удельное сопротивление в скобках указана плотность электролита, имеющего минимальное сопротивление при данном значении температуры.
Таблица 2. Температура замерзания электролита разной плотности.
| Плотность электролита, приведенная к температуру+15 аС, | Температура замерзания электролита, °С | Плотность электролита, приведенная к температуру +15 *С, | Температура замерзания электролита, °С |
| 1,050 | -3,0 | 1,250 | -50,0 |
| 1,075 | -5,0 | 1,260 | -54,0 |
| 1,100 | -7,0 | 1,270 | -58,0 |
| 1,125 | -10,0 | 1,275 | -59,0 |
| 1,150 | -14,0 | 1,280 | -68,0 |
| 1,175 | -19,0 | 1,300 | -68,0 |
| 1,200 | -25,0 | 1,310 | -66,0 |
| 1,225 | -37,0 | 1,400 | -49,0 |
| 1,230 | -39,0 | 1г550 | -38,0 |
| 1,240 | -45,0 | 1,800 | +6,0 |
Таблица 3.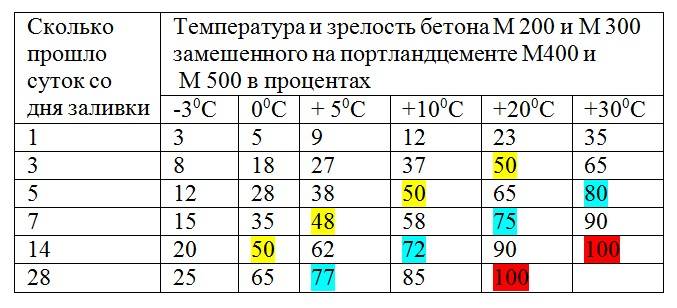 Приготовление электролита заданной плотности по объему и массе серной кислоты.
Приготовление электролита заданной плотности по объему и массе серной кислоты.
| Р, г/см3 | Количество серной кислоты | Р, г/см3 | Количество серной кислоты | ||
| мл | г | мл | г | ||
| 1,21 | 23,0 | 39,7 | 1,31 | 40,3 | 67,5 |
| 1,22 | 24,4 | 42,1 | 1,32 | 42,2 | 70,7 |
| 1,23 | 25,9 | 44,5 | 1,33 | 44,3 | 73,9 |
| 1,24 | 27,6 | 47,1 | 1,34 | 46,6 | 77,3 |
| 1,25 | 29,2 | 49,7 | 1,35 | 48,7 | 80,8 |
| 1,26 | 30,9 | 52,4 | 1,36 | 51,3 | 84,5 |
| 1,27 | 32,6 | 52,7 | 1,37 | 53,6 | 88,3 |
| 1,28 | 34,4 | 58,4 | 1,38 | 56,0 | 91,9 |
| 1,29 | 36,2 | 61,3 | 1,39 | 58,7 | 96,1 |
| 1,30 | 38,1 | 64,2 | 1,40 | 61,3 | 100. 0 0 |
Примечания. 1. Таблица составлена для плотности электролита, приведенной к температуре +15 °С. 2. Для получения электролита заданной плотности к исходному количеству 100 мл (при приготовлении электролита по объему) или 100 г (при приготовлении электролита по массе) дистилированной воды должно быть добавлено указанное в соответвующем столбце таблицы количество (в мл или в г) серной кислоты плотностью 1,840 г/см .
Таблица 4. Максимально допустимое содержание некоторых примесей.
| Вещество | Примеси | |||
| марганец, мышьяк | Железо | Хлористые соединения | Оксиды азота | |
| Серная кислота: марки А | 0,00005 | 0,005 | 0,0005 | 0,00005 |
| марки Б | 0,0001 | 0,012 | 0,0001 | |
| Дистиллированная вода | — | 0,5 | 5,5 | — |
| Электролит | 0,001 | 0,1 | 0,001 | — |
Примечания.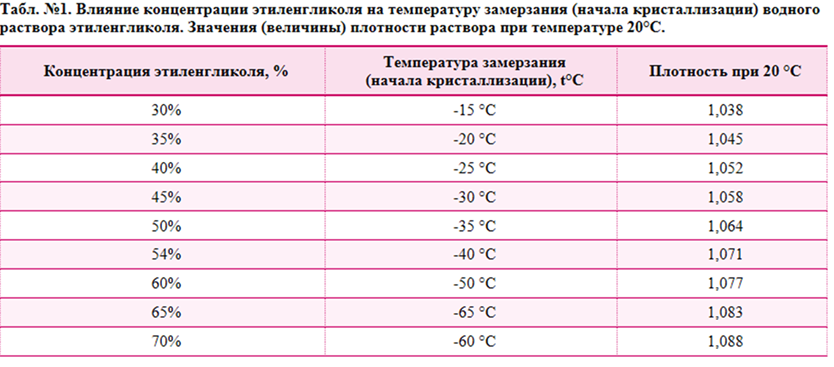 1. Содержание примесей указано для серной кислоты -в %, для дистиллированной воды и электролита — в мг/л. 2. Содержание меди в серной кислоте и дистиллированной воде не допускается. Допускается наличие меди в электролите в количестве не более 0,01 мг/л.
1. Содержание примесей указано для серной кислоты -в %, для дистиллированной воды и электролита — в мг/л. 2. Содержание меди в серной кислоте и дистиллированной воде не допускается. Допускается наличие меди в электролите в количестве не более 0,01 мг/л.
Таблица 5. Корректировка плотности электролита.
| Имеющаяся плотность электролита 1,25 Г/см3 | Требуемая плотность | |||||||||||
| 1,25 Г/см3 | 1,27 Г/см3 | 1,29 Г/смЗ | 1,31 Г/смЗ | |||||||||
| -Э | +КЭ | +В | -Э | +КЭ | +В | -Э | +КЭ | +В | -Э | +КЭ | +В | |
| 1.24 | 61 | 62 | — | 173 | 175 | — | 252 | 256 | — | — | — | — |
| 1,25 | — | — | — | 118 | 119 | — | 215 | 219 | — | — | — | — |
| 1,26 | 39 | — | 40 | 65 | 66 | — | 177 | 180 | — | 290 | 294 | — |
| 1,27 | 78 | — | 80 | — | — | — | 122 | 124 | — | 246 | 249 | — |
| 1,28 | 117 | — | 120 | 40 | — | 42 | 63 | 64 | — | 198 | 201 | — |
| 1,29 | 157 | — | 161 | 75 | — | 78 | — | — | — | 143 | 145 | — |
| 1,30 | — | — | — | 109 | — | 113 | 36 | — | 37 | 79 | 81 | — |
| 1,31 | — | — | — | 143 | — | 148 | 72 | — | 76 | — | — | — |
Примечание. Таблица составлена в расчете на 1 л электролита. В столбцах таблицы применены следующие обозначения: -Э — отобрать электролита; + КЭ — долить концентрированного электролита с плотностью 1,4 г/см3; +В — долить дистиллированной воды; Объемы даны в см3.
Таблица составлена в расчете на 1 л электролита. В столбцах таблицы применены следующие обозначения: -Э — отобрать электролита; + КЭ — долить концентрированного электролита с плотностью 1,4 г/см3; +В — долить дистиллированной воды; Объемы даны в см3.
Литература: В. Ю. Грачев — Как продлить срок службы аккумулятора.
Замерз электролит в аккумуляторе: причины, последствия, что делать
Содержание статьи
- 1 Снижение плотности электролита
- 2 Как не допустить замерзание электролита
- 2.0.1 Видео: Замерз аккумулятор автомобиля. Почему? Что делать? Просто о сложном
- 2.1 Заключение
С наступлением зимы автовладелец может обнаружить, что морозным утром автомобиль не заводится, а дальнейшее исследование покажет, что в аккумуляторе замерз электролит. Такое может случиться и не в самый сильный мороз, хотя при минимальной плотности с завода 1,27 г/см³ замерзание электролита происходит при температуре около -68 С°, а такие условия встречаются редко.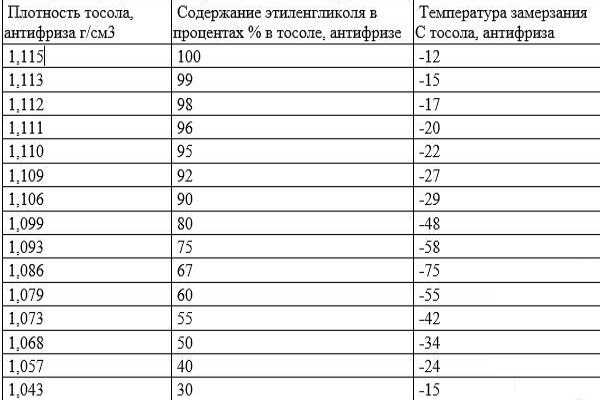 Чтобы не попасть в такую ситуацию, необходимо знать причины, по которым электролит может замерзнуть в аккумуляторной батарее.
Чтобы не попасть в такую ситуацию, необходимо знать причины, по которым электролит может замерзнуть в аккумуляторной батарее.
Снижение плотности электролита
Проблеме замерзания электролита подвержены свинцово-кислотные аккумуляторные батареи, которые устанавливают на большинство современных автомобилей с двигателем внутреннего сгорания. В них используется жидкий электролит, вода в котором и превращается в лед при низких температурах.
В новом аккумуляторе плотность электролита находится в пределах 1,27-1,30 г/см³, чего вполне достаточно для наших климатических условий. Зависимость температуры замерзания от плотности электролита можно увидеть в таблице:
Из таблицы видно, что с увеличением плотности снижается температура, при которой электролит замерзает. Но данная зависимость не является пропорциональной, поскольку при избыточной плотности 1,40 г/см³, температура замерзания скачкообразно повышается. При этом среда в аккумуляторе становится более агрессивной, а это приводит к его ускоренному износу.
Откуда же берется низкая плотность электролита в АКБ? Большинство автолюбителей винят в этом производителя, поэтому пытаются сдать аккумулятор назад, требуя гарантийной замены. Но такие случаи встречаются редко и чаще всего проблема неправильном обслуживании аккумулятора.
Дело в том, что продавец предлагает полностью заряженный аккумулятор, а это значит, что плотность его электролита находится в допустимых пределах, и он не может замерзнуть на обычных морозах. Но при его разрядке часть кислотного компонента оседает на пластинах в виде сульфатов, соответственно, плотность электролита уменьшается, а это приводит к повышению температуры, при которой он может замерзнуть.
При этом прослеживается простая закономерность, если у электролита снижена плотность, значит, АКБ разряжена и его нужно зарядить. Большой ошибкой при этом будет доливка электролита, поскольку, повысив морозостойкость, мы никак не улучшаем электротехнические свойства батареи.
Отсюда делаем вывод: если в аккумуляторной батарее появился лед, значит, она была разряжена и ее нужно немедленно зарядить.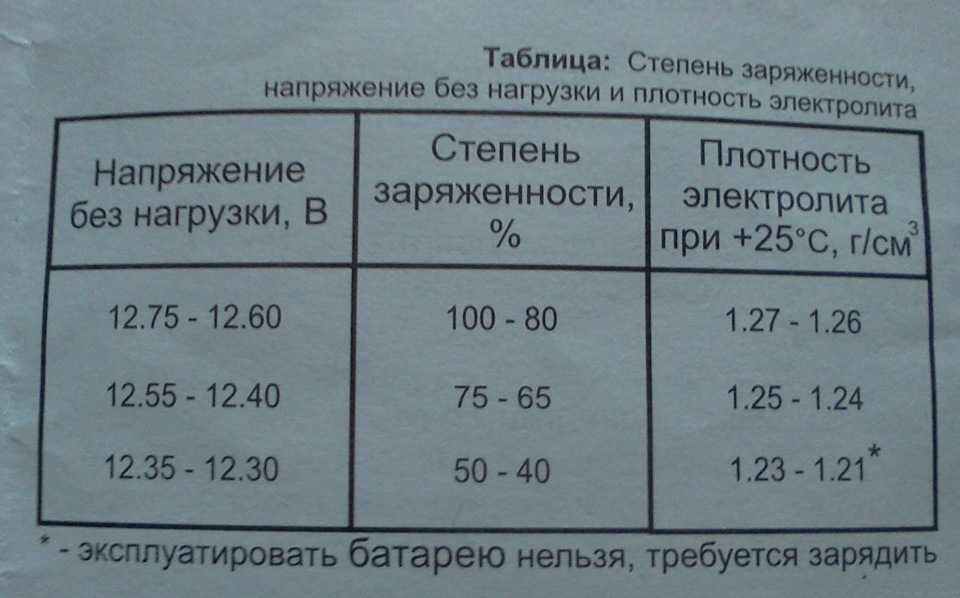
Важно знать, что, если АКБ слегка разряжается в теплое время года и плотность электролита при этом снижается, обнаружить это без замера плотности невозможно, поскольку она спокойно запускает двигатель, справляясь со своей непосредственной задачей. При наступлении же морозов батарея может замерзнуть в лед.
Как не допустить замерзание электролита
Чтобы не стать жертвой замерзшего аккумулятора, необходимо провести определенные операции, которые позволят отследить его состояние. Прежде всего, периодически нужно проверять заряд аккумулятора при помощи мультиметра. Заряженный аккумулятор будет выдавать приблизительно 12,6-12,7 вольт при заглушенном моторе.
При выходе из автомобиля недопустимо оставлять включенными габариты и нужно закрывать двери авто, поскольку горящая лампочка-индикатор, сигнализирующая о незапертой двери может разрядить аккумулятор в течение нескольких суток при длительной стоянке, и этом случае при сильных морозах в аккумуляторе может образоваться лед.
Чтобы не допустить преждевременной разрядки, перед зимой аккумулятор необходимо обслужить. Первое — тщательно вымыть его корпус, поскольку осевшая пыль и грязь проводит электрический ток, а это уменьшает заряд. Если есть доступ к банкам аккумулятора, нужно проверить плотность электролита. Далее нужно полностью зарядить АКБ, после чего установить его в автомобиль.
Если в результате неправильной эксплуатации в АКБ образовался лед, подкуривать его нельзя. Батарею нужно снять с машины, отогреть в теплом помещении и полностью зарядить. Известно, что при замерзании жидкость расширяется, поэтому лед, образовавшийся в банках, может разорвать корпус аккумулятора, замкнуть или повредить цепи внутри. Поскольку такие поломки не относятся к гарантийным случаям, такую батарею никто заменять не будет.
После проведения поточного обслуживания и установки аккумулятора, необходимо проверить утечку тока, что позволит избежать преждевременной разрядки. Не нужно допускать длительных простоев автомобиля, даже если планируется длительная стоянка, автомобиль желательно заводить и прогревать, чтобы аккумулятор подзаряжался. Если это невозможно, специалисты советуют отключить минусовую клемму АКБ, чтобы разорвать цепь аккумулятора и воспрепятствовать его разрядке. Если планируется оставить автомобиль на всю зиму, аккумуляторную батарею нужно снять, зарядить и поместить в сухое прохладное место, например, в погреб.
Если это невозможно, специалисты советуют отключить минусовую клемму АКБ, чтобы разорвать цепь аккумулятора и воспрепятствовать его разрядке. Если планируется оставить автомобиль на всю зиму, аккумуляторную батарею нужно снять, зарядить и поместить в сухое прохладное место, например, в погреб.
Видео: Замерз аккумулятор автомобиля. Почему? Что делать? Просто о сложном
Заключение
Чтобы не допустить ситуации, когда электролит замерзает в банках аккумулятора, достаточно тщательно следить за его состоянием. Даже лучшие аккумуляторы не смогут выдержать неправильной эксплуатации, работать без дополнительного ухода и подзарядки при необходимости. Важно периодически тестировать состояние установленной на машину АКБ, что позволит существенно продлить срок ее эксплуатации и избежать ненужных финансовых трат.
13.8: Понижение температуры замерзания и повышение температуры кипения растворов неэлектролитов
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 24260
Цели обучения
- Для описания взаимосвязи между концентрацией растворенного вещества и физическими свойствами раствора.

- Понять, что общее количество нелетучих частиц растворенного вещества определяет снижение давления паров, повышение температуры кипения и снижение температуры замерзания раствора по сравнению с чистым растворителем.
Многие физические свойства растворов существенно отличаются от свойств чистых веществ, обсуждавшихся в предыдущих главах, и эти различия имеют важные последствия. Например, ограниченный диапазон температур жидкой воды (0°C–100°C) сильно ограничивает ее использование. Водные растворы имеют как более низкую температуру замерзания, так и более высокую температуру кипения, чем чистая вода. Вероятно, одно из наиболее известных применений этого явления — добавление этиленгликоля («антифриза») к воде в автомобильном радиаторе. Это растворенное вещество снижает температуру замерзания воды, предотвращая растрескивание двигателя в очень холодную погоду из-за расширения чистой воды при замерзании. Антифриз также позволяет системе охлаждения работать при температурах выше 100°C, не создавая достаточного давления для взрыва.
Изменения температуры замерзания и кипения раствора зависят в первую очередь от количества присутствующих частиц растворенного вещества, а не от их вида. Такие свойства растворов называются коллигативными свойствами (от латинского colligatus, что означает «связанный вместе», как в количестве). Как мы увидим, давление паров и осмотическое давление растворов также являются коллигативными свойствами.
Когда мы определяем количество частиц в растворе, важно помнить, что не все растворы с одинаковой молярностью содержат одинаковую концентрацию частиц растворенного вещества. Рассмотрим, например, 0,01 М водные растворы сахарозы, \(NaCl\) и \(\ce{CaCl_2}\). Поскольку сахароза растворяется с образованием раствора нейтральных молекул, концентрация растворенных частиц в 0,01 М растворе сахарозы составляет 0,01 М. Напротив, как \(\ce{NaCl}\), так и \(\ce{CaCl_2}\) ионные соединения, диссоциирующие в воде с образованием сольватированных ионов. В результате 0,01 М водный раствор \(\ce{NaCl}\) содержит 0,01 М ионов Na+ и 0,01 М ионов \(Cl^-\) при общей концентрации частиц 0,02 М. {3+}\)), или в растворах с меньшим В полярных растворителях диссоциация с образованием отдельных ионов часто бывает неполной. Сумма концентраций растворенных частиц растворенного вещества определяет физические свойства раствора. Поэтому в последующем обсуждении мы должны твердо помнить о химической природе растворенного вещества.
{3+}\)), или в растворах с меньшим В полярных растворителях диссоциация с образованием отдельных ионов часто бывает неполной. Сумма концентраций растворенных частиц растворенного вещества определяет физические свойства раствора. Поэтому в последующем обсуждении мы должны твердо помнить о химической природе растворенного вещества.
Повышение температуры кипения
Напомним, что нормальной точкой кипения вещества является температура, при которой давление пара равно 1 атм. Если нелетучее растворенное вещество снижает давление паров растворителя, оно также должно влиять на температуру кипения. Поскольку давление паров раствора при данной температуре меньше, чем давление паров чистого растворителя, достижение давления паров 1 атм для раствора требует более высокой температуры, чем нормальная точка кипения растворителя. Таким образом, температура кипения раствора всегда выше, чем у чистого растворителя. Мы можем понять, почему это должно быть так, сравнив фазовую диаграмму водного раствора с фазовой диаграммой чистой воды (рис. \(\PageIndex{1}\)). Давление паров раствора меньше, чем у чистой воды при всех температурах. Следовательно, кривая жидкость–пар для раствора пересекает горизонтальную линию, соответствующую Р = 1 атм, при более высокой температуре, чем кривая для чистой воды.
\(\PageIndex{1}\)). Давление паров раствора меньше, чем у чистой воды при всех температурах. Следовательно, кривая жидкость–пар для раствора пересекает горизонтальную линию, соответствующую Р = 1 атм, при более высокой температуре, чем кривая для чистой воды.
Рисунок \(\PageIndex{1}\): Фазовые диаграммы чистой воды и водного раствора нелетучего растворенного вещества. Кривая испарения раствора лежит ниже кривой чистой воды при всех температурах, что приводит к повышению температуры кипения и понижению температуры замерзания раствора.
Температура кипения раствора нелетучего растворенного вещества всегда выше температуры кипения чистого растворителя.
Величина повышения точки кипения связана с величиной снижения давления пара. Как мы только что обсуждали, уменьшение давления пара пропорционально концентрации растворенного вещества в растворе. Следовательно, величина повышения точки кипения также должна быть пропорциональна концентрации растворенного вещества (рис. \(\PageIndex{2}\)).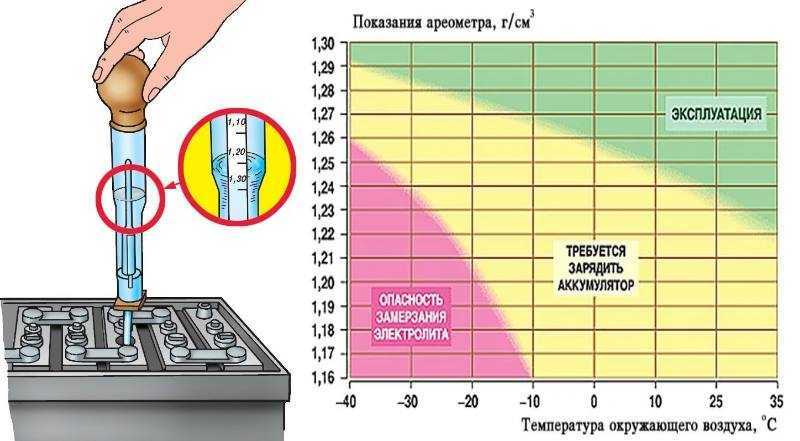 Мы можем определить повышение температуры кипения (\(ΔT_b\)) как разницу между температурами кипения раствора и чистого растворителя: 90_b\) — температура кипения чистого растворителя. Мы можем выразить взаимосвязь между \(ΔT_b\) и концентрацией следующим образом: молярная константа повышения температуры кипения растворителя, выраженная в °C/м. В таблице \(\PageIndex{1}\) перечислены характеристические значения Kb для нескольких широко используемых растворителей.
Мы можем определить повышение температуры кипения (\(ΔT_b\)) как разницу между температурами кипения раствора и чистого растворителя: 90_b\) — температура кипения чистого растворителя. Мы можем выразить взаимосвязь между \(ΔT_b\) и концентрацией следующим образом: молярная константа повышения температуры кипения растворителя, выраженная в °C/м. В таблице \(\PageIndex{1}\) перечислены характеристические значения Kb для нескольких широко используемых растворителей.
Рисунок \(\PageIndex{2}\): Снижение давления паров и повышение температуры кипения в зависимости от мольной доли нелетучего растворенного вещества
Для относительно разбавленных растворов величина обоих свойств пропорциональна концентрации растворенного вещества.
| Растворитель | Температура кипения (°С) | К б (°С/м) | Температура замерзания (°C) | К f (°С/м) |
|---|---|---|---|---|
| уксусная кислота | 117,90 | 3,22 | 16,64 | 3,63 |
| бензол | 80,09 | 2,64 | 5,49 | 5,07 |
| d-(+)-камфора | 207,4 | 4,91 | 178,8 | 37,8 |
| сероуглерод | 46,2 | 2,42 | −112,1 | 3,74 |
| четыреххлористый углерод | 76,8 | 5,26 | −22,62 | 31,4 |
| хлороформ | 61,17 | 3,80 | −63,41 | 4,60 |
| нитробензол | 210,8 | 5,24 | 5,70 | 6,87 |
| вода | 100,00 | 0,51 | 0,00 | 1,86 |
Концентрация растворенного вещества обычно выражается в виде моляльности, а не молярной доли или молярности по двум причинам. Во-первых, поскольку плотность раствора зависит от температуры, значение молярности также зависит от температуры. Если температура кипения зависит от концентрации растворенного вещества, то система по определению не поддерживается при постоянной температуре. Во-вторых, моляльность и молярность пропорциональны для относительно разбавленных растворов, но моляльность имеет большее численное значение (моляльность может быть только между нулем и единицей). Использование моляльности позволяет исключить незначащие нули.
Во-первых, поскольку плотность раствора зависит от температуры, значение молярности также зависит от температуры. Если температура кипения зависит от концентрации растворенного вещества, то система по определению не поддерживается при постоянной температуре. Во-вторых, моляльность и молярность пропорциональны для относительно разбавленных растворов, но моляльность имеет большее численное значение (моляльность может быть только между нулем и единицей). Использование моляльности позволяет исключить незначащие нули.
Согласно таблице \(\PageIndex{1}\), молярная константа повышения температуры кипения воды составляет 0,51°C/м. Таким образом, 1,00 м водный раствор нелетучего молекулярного растворенного вещества, такого как глюкоза или сахароза, будет иметь повышение температуры кипения на 0,51 ° C, что дает температуру кипения 100,51 ° C при 1,00 атм. Повышение температуры кипения 1,00 м водного раствора \(\ce{NaCl}\) будет примерно в два раза больше, чем у раствора глюкозы или сахарозы, так как 1 моль \(\ce{NaCl}\) дает 2 моль растворенных ионов. Следовательно, 1,00 м раствора \(\ce{NaCl}\) будет иметь температуру кипения около 101,02°C.
Следовательно, 1,00 м раствора \(\ce{NaCl}\) будет иметь температуру кипения около 101,02°C.
Пример \(\PageIndex{3}\)
В примере \(\PageIndex{1}\) мы рассчитали, что давление паров 30,2% водного раствора этиленгликоля при 100°C на 85,1 мм рт.ст. меньше, чем давление паров чистой воды. Мы заявили (без предоставления доказательств), что это должно привести к более высокой температуре кипения раствора по сравнению с чистой водой. Теперь, когда мы увидели, почему это утверждение верно, рассчитаем температуру кипения водного раствора этиленгликоля.
Дано : состав раствора
Запрашиваемый : температура кипения
Стратегия :
Рассчитайте моляльность этиленгликоля в 30,2% растворе. Затем используйте уравнение \ref{eq2} для расчета увеличения температуры кипения.
Раствор :
Из примера \(\PageIndex{1}\) мы знаем, что 30,2% раствор этиленгликоля в воде содержит 302 г этиленгликоля (4,87 моль) на 698 г воды. Таким образом, моляльность раствора равна 9.0024
Таким образом, моляльность раствора равна 9.0024
\[\text{моляльность этиленгликоля}= \left(\dfrac{4,87 \;mol}{698 \; \cancel{g} \;H_2O} \right) \left(\dfrac{1000\; \ Cancel{g}}{1 \;kg} \right)=6,98 м\]
Из уравнения \ref{eq2} повышение температуры кипения равно
\[ΔT_b=mK_b=(6,98 \cancel{m })(0,51°C/\cancel{m})=3,6°C\]
Таким образом, температура кипения раствора составляет 104°C. Однако при концентрации растворенного вещества почти 7 m предположение о разбавленном растворе, использованном для получения уравнения \ref{eq2}, может оказаться неверным.
Упражнение \(\PageIndex{3}\)
Предположим, что столовую ложку (5,00 г) \(\ce{NaCl}\) добавляют к 2,00 л воды при 20,0°C, затем доводят до варить спагетти. При какой температуре закипит вода?
- Ответить
100,04°C или 100°C до трех значащих цифр. (Напомним, что 1 моль \(\ce{NaCl}\) дает 2 моля растворенных частиц. Небольшое повышение температуры означает, что добавление соли в воду, используемую для варки макарон, практически не влияет на время варки.
 )
)
Депрессия точки замерзания
Фазовая диаграмма на рисунке \(\PageIndex{1}\) показывает, что растворение нелетучего растворенного вещества в воде не только повышает температуру кипения воды, но и снижает ее температуру замерзания. Кривая твердое тело–жидкость для раствора пересекает линию, соответствующую Р = 1 атм, при более низкой температуре, чем кривая для чистой воды.
Это явление используется в схемах «противообледенения», в которых для растапливания льда на дорогах и тротуарах используется соль (Рис. \(\PageIndex{3}\)), хлорид кальция или мочевина, а также при использовании этиленгликоля в качестве «антифриз» в автомобильных радиаторах. Морская вода замерзает при более низкой температуре, чем пресная, поэтому Северный Ледовитый и Антарктический океаны остаются незамерзающими даже при температуре ниже 0 °С (как и биологические жидкости рыб и других хладнокровных морских животных, обитающих в этих океанах).
Рисунок \(\PageIndex{3}\): Каменная соль (NaCl), хлорид кальция (CaCl 2 ) или их смесь используются для растапливания льда. (кредит: модификация работы Эдди Велкера)
(кредит: модификация работы Эдди Велкера)
Мы можем понять этот результат, представив, что у нас есть образец воды при нормальной температуре точки замерзания, когда существует динамическое равновесие между твердым телом и жидкостью. Молекулы воды постоянно сталкиваются с поверхностью льда и входят в твердую фазу с той же скоростью, с которой молекулы воды покидают поверхность льда и входят в жидкую фазу. Если мы растворим нелетучее растворенное вещество, такое как глюкоза, в жидкости, растворенные молекулы глюкозы уменьшат количество столкновений в единицу времени между молекулами воды и поверхностью льда, потому что некоторые из молекул, сталкивающихся со льдом, будут глюкозой. Глюкоза, однако, имеет совсем другую структуру, чем вода, и не может вписаться в решетку льда. Следовательно, присутствие молекул глюкозы в растворе может только уменьшить скорость, с которой молекулы воды в жидкости сталкиваются с поверхностью льда и затвердевают. При этом скорость, с которой молекулы воды покидают поверхность льда и переходят в жидкую фазу, остается неизменной.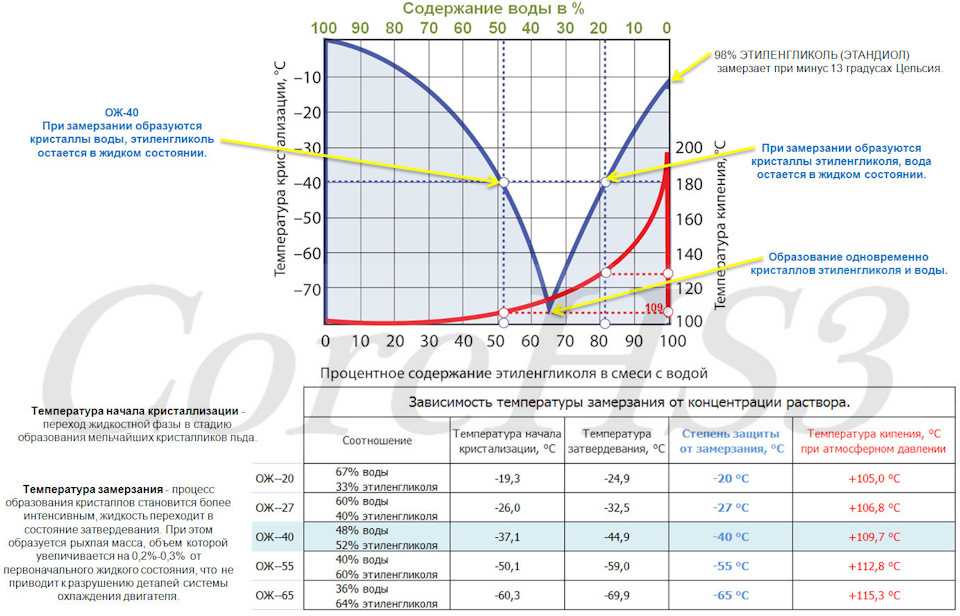 Чистый эффект заключается в том, чтобы заставить лед таять. Единственный способ восстановить динамическое равновесие между твердой и жидкой водой — это понизить температуру системы, что снижает скорость, с которой молекулы воды покидают поверхность кристаллов льда, до тех пор, пока она не сравняется со скоростью, с которой сталкиваются молекулы воды в растворе. со льдом. 90_f\) — точка замерзания чистого растворителя, а
Чистый эффект заключается в том, чтобы заставить лед таять. Единственный способ восстановить динамическое равновесие между твердой и жидкой водой — это понизить температуру системы, что снижает скорость, с которой молекулы воды покидают поверхность кристаллов льда, до тех пор, пока она не сравняется со скоростью, с которой сталкиваются молекулы воды в растворе. со льдом. 90_f\) — точка замерзания чистого растворителя, а
Порядок членов изменен на обратный по сравнению с уравнением \ref{eq1}, чтобы выразить понижение точки замерзания в виде положительного числа. Связь между \(ΔT_f\) и концентрацией растворенного вещества задается уравнением, аналогичным уравнению \ref{eq2}:
\[ΔT_f = mK_f \label{eq4}\]
, где
- \(m\ ) — моляльность раствора, а
- \(K_f\) — молярная константа понижения температуры замерзания растворителя (в единицах °C/м).
Как и \(K_b\), каждый растворитель имеет характеристическое значение \(K_f\) (таблица \(\PageIndex{1}\)). Снижение точки замерзания зависит от общего количества растворенных нелетучих частиц растворенного вещества, так же как и повышение точки кипения. Таким образом, водный раствор \(\ce{NaCl}\) имеет в два раза большую депрессию точки замерзания, чем раствор глюкозы той же моляльности.
Снижение точки замерзания зависит от общего количества растворенных нелетучих частиц растворенного вещества, так же как и повышение точки кипения. Таким образом, водный раствор \(\ce{NaCl}\) имеет в два раза большую депрессию точки замерзания, чем раствор глюкозы той же моляльности.
Люди, живущие в холодном климате, используют снижение точки замерзания во многих отношениях. Например, этиленгликоль добавляют в охлаждающую жидкость двигателя, чтобы предотвратить разрушение автомобильного двигателя, а метанол добавляют в жидкость для омывания ветрового стекла, чтобы предотвратить замерзание жидкости. Нагретые гликоли часто распыляют на поверхность самолетов перед взлетом в ненастную погоду зимой, чтобы удалить уже образовавшийся лед и предотвратить образование большего количества льда, который был бы особенно опасен, если бы образовался на рулевых поверхностях самолета (видео). \(\PageIndex{1}\)).
Видео \(\PageIndex{1}\): Понижение точки замерзания используется для удаления льда с поверхностей управления самолета.
Снижение давления пара, повышение температуры кипения и снижение температуры замерзания раствора по сравнению с чистой жидкостью зависят от общего количества растворенных нелетучих частиц растворенного вещества.
Пример \(\PageIndex{4}\)
В более холодных регионах США \(\ce{NaCl}\) или \(\ce{CaCl_2}\) зимой часто посыпают обледенелые дороги, чтобы растопить лед и сделать вождение более безопасным. Используйте данные на рис. 13.9.оценить концентрации двух насыщенных растворов при 0°C, одного из \(\ce{NaCl}\) и одного из \(\ce{CaCl_2}\), и рассчитать точки замерзания обоих растворов, чтобы увидеть, какая соль вероятно, будет более эффективным при таянии льда.
Дано : растворимости двух соединений
Запрошено : концентрации и точки замерзания
Стратегия :
- Оцените растворимость каждой соли в воде в 1 г. Рис. Определить количество молей каждого из них в 100 г и рассчитать моляльности.

- Определите концентрацию растворенных солей в растворах. Подставьте эти значения в уравнение \(\PageIndex{4}\), чтобы рассчитать понижение температуры замерзания растворов.
Раствор :
A Из рисунка 13.9 мы можем оценить растворимость \(\ce{NaCl}\) и \(\ce{CaCl_2}\) примерно в 36 г и 60 г соответственно. , на 100 г воды при 0°С. Соответствующие концентрации в моляльности составляют
\[m_{\ce{NaCl}}=\left(\dfrac{36 \; \cancel{g \;NaCl}}{100 \;\cancel{g} \;H_2O} \right)\left(\dfrac{1\; моль\; NaCl}{58,44\; \cancel{g\; NaCl}}\right)\left(\dfrac{1000\; \cancel{g}}{1 \;кг}\справа)=6,2\; м\]
\[m_{\ce{CaCl_2}}=\left(\dfrac{60\; \cancel{g\; CaCl_2}}{100\;\cancel{g}\; H_2O}\right)\left( \dfrac{1\;моль\;CaCl_2}{110,98\;\cancel{g\;CaCl_2}}\right)\left(\dfrac{1000 \;\cancel{g}}{1 кг}\right)= 5,4\; m\]
Меньшая формула массы \(\ce{NaCl}\) более чем компенсирует его более низкую растворимость, в результате чего получается насыщенный раствор с немного более высокой концентрацией, чем \(\ce{CaCl_2}\).
B Поскольку эти соли являются ионными соединениями, которые диссоциируют в воде с образованием двух и трех ионов на формульную единицу \(\ce{NaCl}\) и \(\ce{CaCl_2}\), соответственно, фактические концентрации растворенных веществ в двух насыщенных растворах: 2 × 6,2 м = 12 м для \(\ce{NaCl}\) и 3 × 5,4 м = 16 м для \(\ce{CaCl_2}\). Результирующие понижения температуры замерзания можно рассчитать с помощью уравнения \(\PageIndex{4}\):
\[\ce{NaCl}: ΔT_f=mK_f=(12\; \cancel{m})(1,86°C/\cancel{m})=22°C\]
\[\ce{CaCl2} : ΔT_f=mK_f=(16\;\cancel{m})(1,86°C/\cancel{m})=30°C\]
Поскольку точка замерзания чистой воды равна 0°C, фактические точки замерзания растворов -22°С и -30°С соответственно. Обратите внимание, что \(\ce{CaCl_2}\) значительно эффективнее снижает температуру замерзания воды, поскольку его растворы содержат три иона на формульную единицу. На самом деле \(\ce{CaCl_2}\) — это соль, обычно продаваемая для домашнего использования, а также часто используемая на дорогах.
Поскольку растворимость обеих солей уменьшается с понижением температуры, температура замерзания может быть снижена только на определенную величину, независимо от того, сколько соли посыпано на обледенелой дороге. Если температура значительно ниже минимальной температуры, при которой одна из этих солей вызывает таяние льда (скажем, −35 °C), нет смысла использовать соль, пока она не станет теплее
Упражнение \(\PageIndex{4}\ )
Рассчитайте температуру замерзания 30,2%-ного раствора этиленгликоля в воде, давление паров и температуру кипения которого мы рассчитали в примере \(\PageIndex{6}\).8 и примере \(\PageIndex{6}\). 10.
- Ответить
−13,0°С
Пример \(\PageIndex{5}\)
Расположите эти водные растворы в порядке убывания температуры замерзания: 0,1 м KCl, 0,1 м глюкоза, 0,1 м SrCl2, 0,1 м этиленгликоль, 0,1 м бензойная кислота. и 0,1 М HCl.
Дано : моляльности шести растворов
Запрошено: относительных точек замерзания
Стратегия :
- Определите каждое растворенное вещество как сильное, слабое или неинформационное электролит образуются растворенные частицы.

- Умножьте это число на концентрацию раствора, чтобы получить эффективную концентрацию частиц растворенного вещества. Раствор с самой высокой эффективной концентрацией растворенных частиц имеет самое большое понижение температуры замерзания.
Раствор :
A Поскольку молярные концентрации всех шести растворов одинаковы, мы должны сосредоточиться на том, какие из веществ являются сильными электролитами, какие слабыми электролитами, а какие неэлектролитами, чтобы определить фактическое количество частицы в растворе. \(KCl\), \(SrCl_2\) и \(HCl\) равны сильные электролиты , образующие соответственно два, три и два иона на формульную единицу. Бензойная кислота является слабым электролитом (приблизительно одна частица на молекулу), а глюкоза и этиленгликоль являются неэлектролитами (одна частица на молекулу).
B Моляльность растворов в пересчете на общее количество частиц растворенного вещества: \(KCl\) и \(HCl\), 0,2 м; \(SrCl_2\), 0,3 м; глюкоза и этиленгликоль, 0,1 м; бензойная кислота 0,1–0,2 мол. Поскольку величина снижения температуры замерзания пропорциональна концентрации растворенных частиц, порядок точек замерзания растворов следующий: глюкоза и этиленгликоль (самая высокая температура замерзания, наименьшее понижение точки замерзания) > бензойная кислота > \(HCl\ ) = \(KCl\) > \(SrCl_2\).
Поскольку величина снижения температуры замерзания пропорциональна концентрации растворенных частиц, порядок точек замерзания растворов следующий: глюкоза и этиленгликоль (самая высокая температура замерзания, наименьшее понижение точки замерзания) > бензойная кислота > \(HCl\ ) = \(KCl\) > \(SrCl_2\).
Упражнение \(\PageIndex{5}\)
Расположите эти водные растворы в порядке возрастания температуры замерзания: 0,2 м \(NaCl\), 0,3 м уксусной кислоты, 0,1 м \(\ce{CaCl_2}\), и 0,2 М сахарозы.
- Ответить
0,2 м \(\ce{NaCl}\) (низшая точка замерзания) < 0,3 м уксусная кислота ≈ 0,1 м \(\ce{CaCl_2}\) < 0,2 м сахароза (самая высокая точка замерзания)
Повышение температуры кипения и понижение точки замерзания: https://youtu.be/0MZm1Ay6LhU
Определение молярных масс
Осмотическое давление и изменения температуры замерзания, кипения и давления пара прямо пропорциональны концентрации присутствующего растворенного вещества. Следовательно, мы можем использовать измерение одного из этих свойств для определения молярной массы растворенного вещества на основе измерений.
Следовательно, мы можем использовать измерение одного из этих свойств для определения молярной массы растворенного вещества на основе измерений.
Определение молярной массы по понижению точки замерзания
Раствор 4,00 г неэлектролита, растворенного в 55,0 г бензола, замерзает при 2,32 °C. Какова молярная масса этого соединения?
Решение
Мы можем решить эту проблему, выполнив следующие действия.
- Определите изменение температуры замерзания по наблюдаемой температуре замерзания и температуре замерзания чистого бензола (таблица \(\PageIndex{1}\)).
\(ΔT_\ce{f}=\mathrm{5,5\:°C−2,32\:°C=3,2\:°C}\)
- Определите молярную концентрацию по K f , константа депрессии точки замерзания бензола 9{−1}}=0,63\:м\)
- Определите число молей соединения в растворе по моляльной концентрации и массе растворителя, использованного для приготовления раствора.
 2\:г/моль}\)
2\:г/моль}\)
Упражнение \(\PageIndex{6}\)
Раствор 35,7 г неэлектролита в 220,0 г хлороформа имеет температуру кипения 64,5 °С. Какова молярная масса этого соединения?
- Ответить
1,8 × 10 2 г/моль
Определение молярной массы по осмотическому давлению
Проба объемом 0,500 л водного раствора, содержащего 10,0 г гемоглобина, имеет осмотическое давление 5,9{−4}\:mol}\)
Упражнение \(\PageIndex{7}\)
Какова молярная масса белка, если раствор 0,02 г белка в 25,0 мл раствора имеет осмотическое давление 0,56 торр при 25 °C?
- Ответить
2,7 × 10 4 г/моль
Определение молекулярной массы неизвестного с помощью коллигативных свойств:
https://youtu. be/faSk2REYy74
be/faSk2REYy74
Резюме
90_B \]
Коллигативные свойства раствора зависят только от общего количества растворенных в растворе частиц, а не от их химической идентичности. Коллигативные свойства включают давление пара, температуру кипения, точку замерзания и осмотическое давление. Добавление нелетучего растворенного вещества (без измеримого давления паров) снижает давление паров растворителя. Давление паров раствора пропорционально мольной доле растворителя в растворе, соотношение, известное как Закон Рауля . Растворы, подчиняющиеся закону Рауля, называются идеальными растворами. Большинство реальных решений демонстрируют положительные или отрицательные отклонения от закона Рауля. Повышение температуры кипения (\(ΔT_b\)) и снижение температуры замерзания (\(ΔT_f\)) раствора определяется как разница между точками кипения и замерзания, соответственно, раствора и чистого растворителя. Оба пропорциональны моляльности растворенного вещества.
Оба пропорциональны моляльности растворенного вещества.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Теги
- повышение точки кипения
- понижение точки замерзания
Депрессия точки замерзания — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 1592
Понижение точки замерзания — это коллигативное свойство, наблюдаемое в растворах, возникающее в результате введения молекул растворенного вещества в растворитель. Все температуры замерзания растворов ниже, чем у чистого растворителя, и прямо пропорциональны моляльности растворенного вещества.
Все температуры замерзания растворов ниже, чем у чистого растворителя, и прямо пропорциональны моляльности растворенного вещества.
\[\Delta{T_f} = T_f(растворитель) — T_f (раствор) = K_f \times m\]
где \(\Delta{T_f}\) — понижение температуры замерзания, \(T_f\) (раствор) — температура замерзания раствора, \(T_f\) (растворитель) — температура замерзания растворителя, \ (K_f\) — постоянная понижения температуры замерзания, а м – моляльность.
Введение
Неэлектролиты – это вещества, не содержащие ионов, только молекулы. Сильные электролиты, с другой стороны, состоят в основном из ионных соединений, и практически все растворимые ионные соединения образуют электролиты. Поэтому, если мы сможем установить, что вещество, с которым мы работаем, однородно и не является ионным, можно с уверенностью предположить, что мы работаем с неэлектролитом, и мы можем попытаться решить эту проблему, используя наши формулы. Это, скорее всего, будет иметь место для всех проблем, с которыми вы столкнетесь, связанных с понижением точки замерзания и повышением точки кипения в этом курсе, но рекомендуется следить за ионами. Стоит отметить, что эти уравнения работают как для летучих, так и для нелетучих растворов. Это означает, что для определения понижения точки замерзания или повышения точки кипения давление паров не влияет на изменение температуры. Кроме того, помните, что чистый растворитель — это раствор, в который ничего не добавлялось и не растворялось. Мы будем сравнивать свойства этого чистого растворителя с его новыми свойствами при добавлении к раствору.
Стоит отметить, что эти уравнения работают как для летучих, так и для нелетучих растворов. Это означает, что для определения понижения точки замерзания или повышения точки кипения давление паров не влияет на изменение температуры. Кроме того, помните, что чистый растворитель — это раствор, в который ничего не добавлялось и не растворялось. Мы будем сравнивать свойства этого чистого растворителя с его новыми свойствами при добавлении к раствору.
Добавление растворенных веществ к идеальному раствору приводит к положительному ΔS, увеличению энтропии. Из-за этого химические и физические свойства вновь измененного раствора также изменятся. Свойства, которые изменяются из-за добавления растворенных веществ в растворитель, известны как коллигативные свойства. Эти свойства зависят от количества добавленных растворенных веществ, а не от их идентичности. Двумя примерами коллигативных свойств являются температура кипения и температура замерзания: из-за добавления растворенных веществ температура кипения имеет тенденцию к увеличению, а точка замерзания имеет тенденцию к снижению.
Точка замерзания и точка кипения чистого растворителя могут быть изменены при добавлении к раствору. Когда это происходит, температура замерзания чистого растворителя может стать ниже, а точка кипения может стать выше. Степень этих изменений можно найти по формулам:
\[\Delta{T}_f = -K_f \times m\]
\[\Delta{T}_f = K_b \times m\]
, где \(m\) — моляльность растворенного вещества , а значения \(K\) — константы пропорциональности; (\(K_f\) и \(K_b\) для замораживания и кипения соответственно.
Если нахождение константы пропорциональности не является конечной целью задачи, эти значения, скорее всего, будут даны. Некоторые общие значения для \(K_f\) и \(K_b\) соответственно:
| Растворитель | \(К_ф\) | \(К_б\) |
|---|---|---|
| Вода | 1,86 | .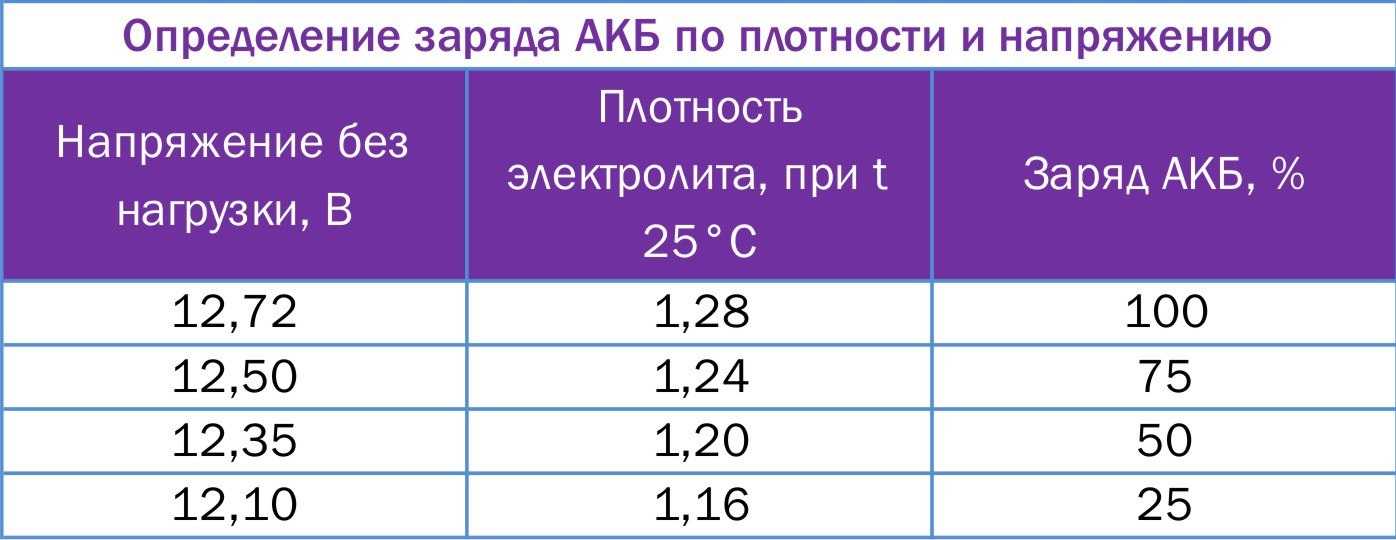 512 512 |
| Уксусная кислота | 3,90 | 3,07 |
| Бензол | 5,12 | 2,53 |
| Фенол | 7,27 | 3,56 |
Моляльность определяется как количество молей растворенного вещества на килограмм растворителя . Будьте осторожны, чтобы не использовать массу всего раствора. Часто задача даст вам изменение температуры и константу пропорциональности, и вы должны сначала найти моляльность, чтобы получить окончательный ответ.
Растворенное вещество, чтобы оказывать какое-либо изменение на коллигативные свойства, должно удовлетворять двум условиям. Во-первых, он не должен вносить вклад в давление паров раствора, а во-вторых, он должен оставаться в растворе во взвешенном состоянии даже во время фазовых переходов.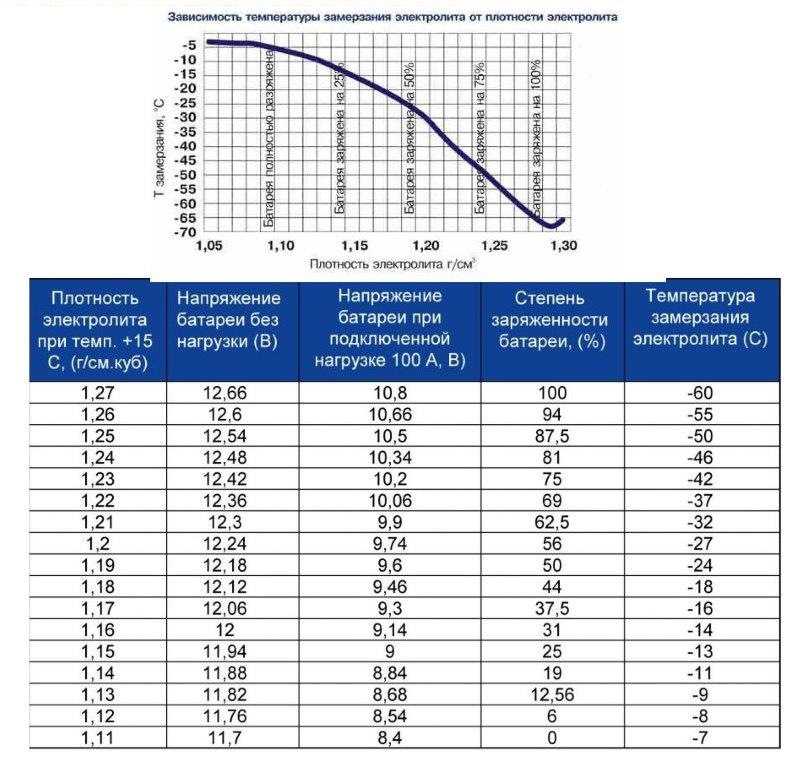 Поскольку растворитель перестает быть чистым при добавлении растворенных веществ, мы можем сказать, что химический потенциал растворителя ниже. Химический потенциал — это молярная энергия Гибба, которую может дать смеси один моль растворителя. Чем выше химический потенциал растворителя, тем больше он способен стимулировать реакцию. Следовательно, растворители с более высоким химическим потенциалом также будут иметь более высокое давление паров.
Поскольку растворитель перестает быть чистым при добавлении растворенных веществ, мы можем сказать, что химический потенциал растворителя ниже. Химический потенциал — это молярная энергия Гибба, которую может дать смеси один моль растворителя. Чем выше химический потенциал растворителя, тем больше он способен стимулировать реакцию. Следовательно, растворители с более высоким химическим потенциалом также будут иметь более высокое давление паров.
Точка кипения достигается, когда химический потенциал чистого растворителя, жидкости, достигает химического потенциала чистого пара. Из-за уменьшения химического потенциала смешанных растворителей и растворенных веществ мы наблюдаем это пересечение при более высоких температурах. Другими словами, температура кипения нечистого растворителя будет выше, чем у чистого жидкого растворителя. Таким образом, повышение температуры кипения происходит при повышении температуры, которое количественно определяется с помощью
\[\Delta{T_b} = K_b b_B\]
где
- \(K_b\) известен как эбуллиоскопическая постоянная и
- \(m\) — моляльность растворенного вещества.

Точка замерзания достигается, когда химический потенциал чистого жидкого растворителя достигает потенциала чистого твердого растворителя. Опять же, поскольку мы имеем дело со смесями с пониженным химическим потенциалом, мы ожидаем, что температура замерзания изменится. В отличие от точки кипения, химический потенциал нечистого растворителя требует более низкой температуры, чтобы он достиг химического потенциала чистого твердого растворителя. Следовательно, 9{\circ}C / m} \\[4pt] &= 0,123 м \end{align*}\]
\[ \begin{align*} \text{Количество растворенного вещества} &= 0,07500 \; кг \; бензол \times \dfrac{0,123 \; м}{1 \; кг \; бензол} \\[4pt] &= 0,00923 \; м\; растворенное вещество \end{align*}\]
Теперь мы можем найти молекулярную массу неизвестного соединения:
\[ \begin{align*} \text{Молекулярная масса} =& \dfrac{2.00 \; г \; неизвестно {0,00923 \; моль} \\[4pt] &= 216,80 \; г/моль \end{align*}\]
Понижение точки замерзания особенно важно для водных организмов. Поскольку соленая вода замерзает при более низких температурах, организмы могут выжить в этих водоемах.
Поскольку соленая вода замерзает при более низких температурах, организмы могут выжить в этих водоемах.
Области применения
Посолка дорог использует этот эффект для снижения точки замерзания льда, на который она наносится. Снижение точки замерзания позволяет уличному льду таять при более низких температурах. Максимальное снижение температуры замерзания составляет около -18 ° C (0 ° F), поэтому, если температура окружающей среды ниже, \(\ce{NaCl}\) будет неэффективным. В этих условиях можно использовать \(\ce{CaCl_2}\), поскольку он растворяется с образованием трех ионов вместо двух для \(\ce{NaCl}\).
Рисунок \(\PageIndex{1}\): Рабочие вручную разбрасывают соль из соляного грузовика в Милуоки, штат Висконсин. из Википедии
Проблемы
Бензофенон имеет температуру замерзания 49,00 o С. 0,450 молярный раствор мочевины в этом растворителе имеет температуру замерзания 44,59 o С. Найдите константу понижения температуры замерзания растворителя (ответ: 9,80oC/м)
Ссылки
- Аткинс, Питер и де Паула, Хулио.

 )
)

 2\:г/моль}\)
2\:г/моль}\)
