Содержание
Устройство и принцип работы аккумулятора автомобиля
Аккумулятор — это важнейшая деталь машины, поэтому поддержание батареи в исправном состоянии будет являться залогом эффективного запуска двигателя, а также бесперебойной работы бортовых потребителей электричества. Чтобы правильно эксплуатировать АКБ необходимо ознакомиться с основными принципами работы этого устройства. В этой статье будут подробно рассказано, как устроен автомобильный аккумулятор.
Содрежание
- Из чего состоит аккумулятор
- Как устроен аккумулятор
- Принцип работы аккумулятора
- Особенности конструкций
Из чего состоит аккумулятор
Автомобильный элемент питания собирается на заводе из многих элементов, поэтому для понимания принципа работы источника электрического тока необходимо знать назначение каждого компонента. Аккумуляторная батарея состоит из следующих частей.
Корпус. Современная АКБ изготавливается из ударопрочного полипропилена. Этот материал хорошо переносит не только повышенные механические нагрузки и вибрации, но и устойчив к воздействую кислоты, которая в виде раствора заполняет внутренние полости батареи. Кроме этого полипропилен устойчив к большим перепадам температуры. Корпус АКБ разделён на 6 герметически отделённых между собой секций, в которые, в процессе изготовления батареи, устанавливаются свинцовые электроды и сепараторы.
Этот материал хорошо переносит не только повышенные механические нагрузки и вибрации, но и устойчив к воздействую кислоты, которая в виде раствора заполняет внутренние полости батареи. Кроме этого полипропилен устойчив к большим перепадам температуры. Корпус АКБ разделён на 6 герметически отделённых между собой секций, в которые, в процессе изготовления батареи, устанавливаются свинцовые электроды и сепараторы.
Сепараторы. Сепараторы устанавливаются между электродами и служат диэлектриками, которые надёжно предохраняет элементы батареи от короткого замыкания. Эти элементы также изготавливаются из кислотоустойчивого полимера, который не разрушается при воздействии агрессивной среды в течение всего времени эксплуатации АКБ.
Электроды. В большинстве выпускаемых аккумуляторных батарей используются свинцовые пластины с различными примесями, в ячейках которых находится масса, состоящая из свинцового порошка и серной кислоты. Пластины современных аккумуляторов могут быть изготовлены из свинца легированного кальцием, что позволяет значительно увеличить ресурс батареи.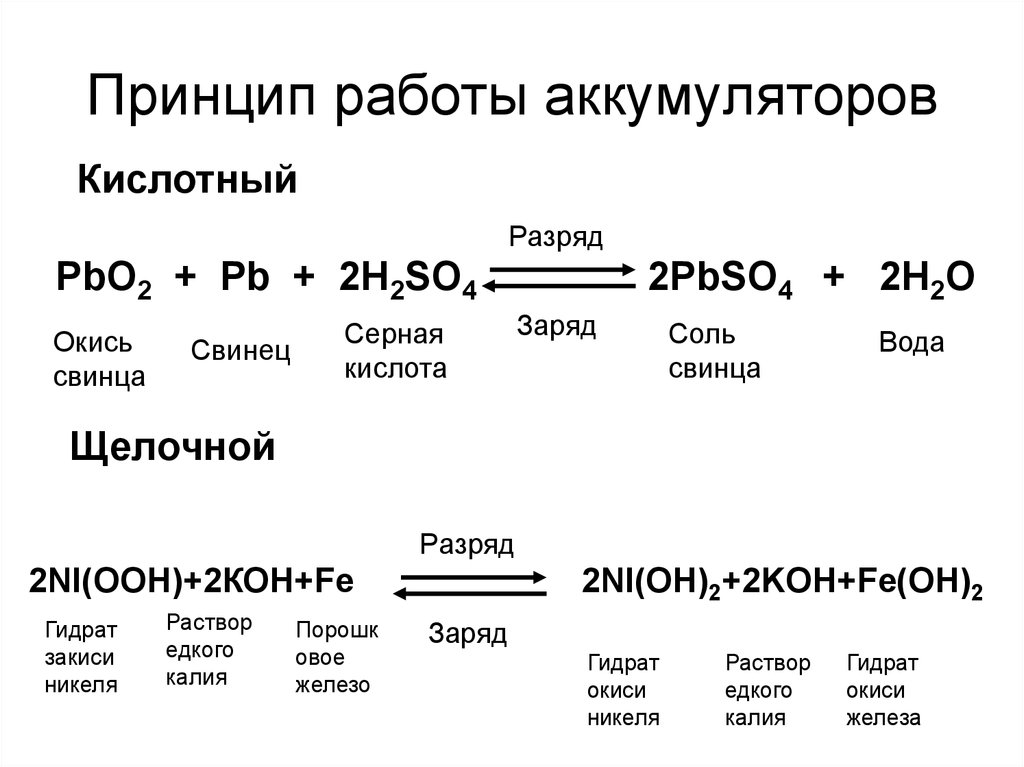
Электролит. Электролит представляет собой раствор серной кислоты и дистиллированной воды. Эта жидкость необходима для того, чтобы электрический ток свободно протекал от отрицательных электродов к положительным. В дорогих батареях вместо жидкого электролита он может быть запечатанным использован гель. Благодаря этим качествам гелевые аккумуляторы выпускаются в виде полностью необслуживаемых изделий.
Клеммы. У всех батарей имеются клеммы, они могут быть разных типов стандартные (европейские), ASIA (тонкие конусы для азиатских автомобилей) и винтовые (для американских автомобилей). Изредка можно встреть батареи с четырьмя клеммами на корпусе.
Дополнительный функционал:
- У необслуживаемых батарей вместо стандартных шести пробок по бокам имеются 2 клапана сброса давления (в случае закипания электролита через них будет сбрасываться газ).
- Некоторые аккумуляторы оснащены «глазком», с помощью которого можно легко определить степень заряженности и уровень электролита.

Как устроен аккумулятор
Аккумуляторная батарея устроена таким образом, чтобы в результате подачи на её клеммы постоянного тока происходило эффективное накапливание электрической энергии. Автомобильная АКБ состоит из 6 изолированных друг от друга ёмкостей, в которых находятся отрицательные и положительные пластины, отделённые между собой сепараторами.
Каждая такая банка позволяет аккумулировать электрический ток напряжением до 2,1 В. Для получения стандартного напряжения бортовой сети автомобиля, применяется схема последовательного подключения таких электрических элементов. Немаловажной особенностью современных кислотных аккумуляторов является полная герметизация корпуса изделия. Несмотря на невозможность обслуживания устройств накопления электроэнергии этого типа, их функциональность и безопасность использования находится на более высоком уровне по сравнению с изделиями с пробками.
Принцип работы аккумулятора
Автомобильный свинцовый аккумулятор представляет собой восстанавливаемый химический элемент питания, в котором образование электричества происходит в результате реакции между двуокисью свинца, губчатым свинцом и раствором серной кислоты.
При подаче постоянного тока на клеммы аккумулятора на отрицательных пластинах образуется чистый свинец, а на положительных – диоксид свинца. При подключении батареи к различным устройствам и агрегатам, потребляющим электроэнергию, происходит обратный процесс, при котором на отрицательных электродах образуется сульфат свинца, а из электролита высвобождается чистая вода.
В зависимости от типа аккумуляторной батареи такая последовательность может повторяться тысячи раз, прежде чем произойдёт сульфатация или разрушение пластин.
Особенности конструкций
Аккумуляторные батареи могут существенно отличаться друг от друга. К особенностям конструкции АКБ можно отнести:
- Размер аккумулятора.
- Состав металлического сплава пластин.
- Вид электролита.
- Расположение электрических выводов на корпусе.
От размера пластин и количества электролита в каждой банке будет зависеть ёмкость АКБ, поэтому изделия, устанавливаемые для запуска дизельных установок грузовых автомобилей, могут в несколько раз превышать по массе и объёму батареи для легковых авто.
От вида свинцового сплава будет зависеть внутреннее электрическое сопротивление батареи и устойчивость элемента к воздействию агрессивной среды. Также состав металла будет влиять на интенсивность испарения влаги, поэтому для необслуживаемых моделей пластины изготавливаются из легированного кальцием свинца.
От вида электролита, применяемого в банках аккумулятора, также зависит большое количество параметров батареи. Жидкий раствор замерзает при низких температурах воздуха, а при кипении приводит к испарению воды, поэтому замена его на гель позволяет существенно увеличить ресурс изделий. Гелевые аккумуляторы значительно лучше переносят глубокий разряд, что позволяет использовать их не только в качестве пусковых устройств, но и для питания силовых электрических установок.
Аккумуляторы могут отличаться и по расположению клемм на корпусе. Этот параметр следует обязательно учитывать при подборе новой АКБ, иначе потребуется удлинять плюсовой провод автомобиля, подключаемый к источнику питания.
Как работает аккумулятор — принцип работы АКБ простыми словами
Содержание
- Понятие аккумулятор и его устройство
- Как работает аккумулятор (АКБ) при разряде
- Работа аккумулятора при заряде
- Способы соединения аккумуляторов (как работает аккумулятор)
- Параллельное соединение (как работает аккумулятор)
- Последовательное соединение (как работает аккумулятор)
- Компоновка АКБ
- Виды аккумуляторов
- Классификация АКБ по составу активного вещества
- Виды АКБ
- Классификация батарей по типу электролита
- Как работает аккумулятор — АКБ
- Материалы АКБ
- Пластины
- Сепараторы
- Литий-ионные аккумуляторы
- Электролит
- Гелевые электролиты
- Графен-полимерные аккумуляторы
- Основные технические характеристики аккумуляторов
- Номинальная емкость аккумулятора
- Пусковой ток
- Полярность
- Устройство корпуса
- Тип крепления аккумулятора
- Заключение
Аккумулятор или сокращённо (АКБ), это основное и необходимое устройство в любом автомобиле.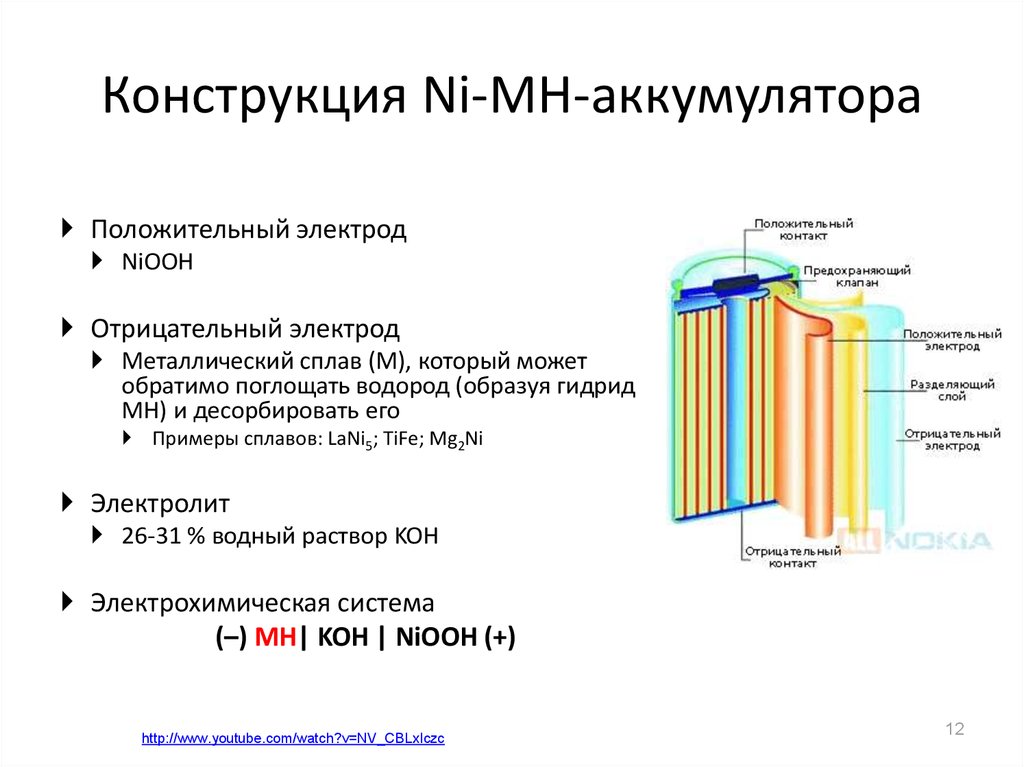 Каждый водитель знает, что серце его машины — это конечно же аккумулятор, и нет таких машин с двигателем внутреннего сгорания, где бы его не было. Как бы это устройство не менялось за 150 лет с момента его изобретения, принцип работы аккумуляторной батареи остался низменным. Однако, современность внесла серьёзные коррективы в технологические процессы их изготовления. В этой статье вы ознакомитесь с и используемыми материалами, из чего состоит аккумулятор и как он работает. Итак, как работает аккумулятор (АКБ)?
Каждый водитель знает, что серце его машины — это конечно же аккумулятор, и нет таких машин с двигателем внутреннего сгорания, где бы его не было. Как бы это устройство не менялось за 150 лет с момента его изобретения, принцип работы аккумуляторной батареи остался низменным. Однако, современность внесла серьёзные коррективы в технологические процессы их изготовления. В этой статье вы ознакомитесь с и используемыми материалами, из чего состоит аккумулятор и как он работает. Итак, как работает аккумулятор (АКБ)?
Как работает аккумулятор (АКБ)
Понятие аккумулятор и его устройство
В общем понимании этого слова в технике под термином «Аккумулятор» подразумевается устройство, позволяющие при разных условиях эксплуатации накапливать определенный вид энергии, либо же — расходовать ее для человеческих нужд.
Хотите узнать, как построить энергосберегающий дом? Смотрите секреты строительства дома , который сам экономит
Применимы в тех ситуациях, когда необходимо собрать энергию за определенное время, после чего использовать ее для совершения больших трудоемких процессов. Так — гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Так — гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Электрические аккумуляторы работают с электроэнергией по такому же принципу: когда вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а после отдают его подключенным приборам для совершения дальнейшей работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
В процессе работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
Узнайте больше о самовозобновляемой и бесплатной энергии будущего. Солнечные батареи в действии.
На рисунке ниже изображена схема устройства аккумулятора. Изображен тот вид, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
Устройство аккумулятора
Как работает аккумулятор (АКБ) при разряде
В момент, когда к электродам подключена нагрузка в виде лампочки, создается замкнутая электрическая цепь, через которую протекает ток разряда. Его формированию способствует движение электронов в металлических частях и анионов с катионами в электролите.
Этот процесс условно показан на схеме с никель-кадмиевой конструкцией электродов.
Заряд и разряд аккумулятора
В данном примере в качестве материала положительного электрода используют окислы никеля с добавками графита, которые повышают электрическую проводимость. Металлом отрицательного электрода работает губчатый кадмий.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.
Общее устройство и маркировка аккумуляторных батарей
Работа аккумулятора при заряде
Беря за основу отключенную нагрузку на клеммы пластин, подаем постоянное (в определенных ситуациях пульсирующее) напряжение большей величины, чем у заряжаемого аккумулятора с той же полярностью, когда плюсовые и минусовые клеммы источника и потребителя совпадают.
Таким образом мощность зарядного устройства всегда больше, чем та, которая «подавляет» оставшуюся в аккумуляторе энергию и создает электрический ток с направлением, противоположным разряду. Это приводит к изменениям внутренних химических процессов между электродами и электролитом. К примеру на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
При разряде и заряде аккумулятора происходит изменение химического состава материала пластин (электродов), а электролита не меняется.
Способы соединения аккумуляторов (как работает аккумулятор)
Параллельное соединение (как работает аккумулятор)
Величина разряда тока, зависит от многих факторов, хотя в первую очередь от конструкции, примененных материалов и их габаритов. Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Этот принцип используется для параллельного подключения однотипных банок у аккумуляторов при необходимости увеличения тока на нагрузку. Чтобы зарядить такую конструкцию потребуется поднять мощность источника. Этот способ используется редко для готовых конструкций, в настоящее время куда проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
Чтобы зарядить такую конструкцию потребуется поднять мощность источника. Этот способ используется редко для готовых конструкций, в настоящее время куда проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
Последовательное соединение (как работает аккумулятор)
В зависимости от применяемых материалов, между двумя электродными пластинами распространенных в быту аккумуляторов может быть выработано напряжение 1,2/1,5 или 2,0 вольта. На самом деле этот диапазон гораздо шире. И многим электрическим приборов его явно недостаточно. Поэтому однотипные аккумуляторы подключают последовательно, делают это зачастую в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов.
Часто среди водителей транспорта, под понятием «аккумулятор» принято понимать любое устройство, независящее от количества его составных элементов — банок. Это не является правильным. Собранная из нескольких последовательно подключенных банок конструкция считается уже батареей, за которой закрепилось сокращенное название «АКБ». Ее внутреннее устройство показано на рисунке.
Это не является правильным. Собранная из нескольких последовательно подключенных банок конструкция считается уже батареей, за которой закрепилось сокращенное название «АКБ». Ее внутреннее устройство показано на рисунке.
Устройство кислотной аккумуляторной батареи (АКБ)
Любая банка состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Благодаря соединению пластин в блоки увеличивается их рабочая площадь. Это снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
Компоновка АКБ
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
Компоновка кислотной аккумуляторной батареи (АКБ)
Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами. Они обычно имеют конусную форму, для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». При этом есть одно правило: во избежании ошибок при подключении, диаметр положительной клеммы немного больше, чем у отрицательной.
Они обычно имеют конусную форму, для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». При этом есть одно правило: во избежании ошибок при подключении, диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки помещена заливная горловина, чтобы контролировать уровень электролита либо доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, предохраняющая внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Для того, чтобы предотвратить бурное выделение газов из электролита, который возможен при интенсивной езде, в пробках делаются отверстия для предотвращения повышения давления внутри банки. И через эти отверстия выходят кислород и водород, а также пары электролита. Такие ситуации, связанные с чрезмерными токами заряда, желательно избегать.
На том же рисунке выше показано соединение элементов между банками и расположение пластин-электродов.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс, что сопровождается изменением химического состава активной массы электродов с выделением или поглощением в электролит (серную кислоту) воды.
Этим явлением можно объяснить повышение удельной плотности электролита при заряде, а так же снижение при разряде батареи. Иными словами, величина плотности дает возможность оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
В состав электролита кислотных батарей входит дистиллированная вода. Она же при отрицательной температуре переходит в твердое состояние — лед. Поэтому, чтобы автомобильные аккумуляторы не замерзали в холодное время, необходимо применять специальные меры, предусмотренные правилами эксплуатации.
Виды аккумуляторов
Классификация АКБ по составу активного вещества
Свинцовые пластины, используемые в старых аккумуляторах перестали устраивать потребителей. Таким образом, возникала необходимость по улучшению качества работы АКБ. Сначала добавили сурьму к свинцу, что позволило заметно продлить срок эксплуатации батареи. На следующем этапе – уменьшили процентное содержания сурьмы до оптимальной концентрации. Такой подход привел к созданию малообслуживаемых аккумуляторов, характерной чертой которых является более редкий процесс долива воды.
Таким образом, возникала необходимость по улучшению качества работы АКБ. Сначала добавили сурьму к свинцу, что позволило заметно продлить срок эксплуатации батареи. На следующем этапе – уменьшили процентное содержания сурьмы до оптимальной концентрации. Такой подход привел к созданию малообслуживаемых аккумуляторов, характерной чертой которых является более редкий процесс долива воды.
При использовании металлического кальция для покрытия пластин появились кальциевые энергосберегающие источники. В предыдущих моделях потери воды из-за электролиза на 12 вольт нуждались в постоянном доливе, а кальций позволил повысить этот порог до 16 вольт. Так появилась возможность в производстве необслуживаемых аккумуляторов и использовать герметичный, неразборной корпус.
Виды АКБ
- Сурьмянистые батареи. Этот вид относится к классике из-за повышенного состава сурьмы, которая ускоряет процесс электролиза.
- АКБ со свинцом. В малосурьмянистых АКБ материалом для пластин служит свинец с небольшой примесью сурьмы.
 В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ.
В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ. - Калициевые источники. При производстве кальциевых источников свинцовые пластины легированы до 0,1% кальцием. Они могут иметь различные заряды, как отрицательный, так и положительный.
- Гибридные источники энергии вытесняют кальциевые. При их производстве, две объединенные основные технологии имеют конструктивные отличия: одна, когда пластины формируются из сплава свинца и сурьмы, положительные электроды, а другая – когда пластины формируются из сплава свинца и кальция, отрицательные электроды.
- EFB является улучшенной жидкозаполненной батареей. Свинцовые пластины в ЕФБ аккумуляторах в два раза толще, чем у обычных, вследствие чего увеличивается их ёмкость. Каждая платина закрыта в пакет из специальной ткани, который наполнен жидким сернокислотным электролитом.
- В гелевых аккумуляторах применяется гелеобразный электролит. Суть такой технологии в том, что она позволяет снизить текучесть электролита, который содержит агрессивную серную кислоту.

- В литиевых АКБ используется жидкий электролит, представляющий собой раствор фторсодержащих солей лития в смеси эфиров угольной кислоты.
- AGM имеет отличительную особенность в электролите, где с помощью специальной технологии между пластинами вставляются стекловолоконные микропористые прокладки.
- Во всех щелочных батареях применяется растворенная в воде щёлочь.
Классификация батарей по типу электролита
Электролиты бывают кислотными и щелочными.
Щелочные растворы применяются в заправке аккумуляторных батарей. Щелочные аккумуляторные жидкости этот такие жидкости, которые проявляют большую активность по отношению к металлам и кислотам. При реакциях с кислотами образуются соль и вода. Растворы щелочей подвергаются гидролизу. Химические свойства позволяют использовать этот тип электропроводящей жидкости для накопления электрической энергии в аккумуляторе.
Кислотные смеси с дистиллированной водой применяются в основном в автомобильных аккумуляторах. Составы этого типа легко можно приобрести в специализированных магазинах либо, при желании, приготовить самостоятельно на дому. На заводе процесс изготовления таких смесей осуществляется в масштабном производстве по ГОСТу. В домашней обстановке его приготовление так же возможно при соблюдении обязательных пропорций и правил техники безопасности. Для этого нужно смешать кислоту с дистиллированной водой.
Составы этого типа легко можно приобрести в специализированных магазинах либо, при желании, приготовить самостоятельно на дому. На заводе процесс изготовления таких смесей осуществляется в масштабном производстве по ГОСТу. В домашней обстановке его приготовление так же возможно при соблюдении обязательных пропорций и правил техники безопасности. Для этого нужно смешать кислоту с дистиллированной водой.
Как работает аккумулятор — АКБ
Как работает аккумулятор (АКБ)
Принцип работы аккумулятора основан на электрохимической реакции окисления свинца в растворе серной кислоты и воды.
При разрядке батареи на положительной пластине происходит окисление металлического свинца, в то время, как на отрицательной пластине восстанавливается уже диоксид свинца.
При зарядке происходит обратный процесс, количество диоксида свинца на отрицательной пластине уменьшается, а на положительной пластине увеличивается количество металла.
Так же при разрядке АКБ уменьшается количество серной кислоты в электролите и увеличивается количество воды. А при зарядке происходит обратный процесс.
А при зарядке происходит обратный процесс.
Материалы АКБ
Пластины
На данный момент наиболее качественные батареи потерпели небольшие изменения. И связаны эти изменения с материалом пластин. Теперь пластины делают не из чистого свинца, а из его сплава с серебром. При этом удалось снизить массу батареи на треть, а срок её службы увеличить на 20 %.
Кроме этого, изменилась сама технология их изготовления. Если первые пластины производились путём их литья, то сегодня их делают из тонкого свинцового листа, путём штамповки. Такой метод дешевле и при этом пластины получаются прочнее и тоньше.
Сепараторы
Одной из причин выхода АКБ из строя является короткое замыкание положительных и отрицательных пластин.
Когда из пластин осыпается активная зона внизу банок происходит замыкание. Чтобы этого не случилось на помощь приходят сепараторы, которые делают в виде конвертов, запаянных снизу, под пластинами. Таким образом, когда активная зона осыпается она остаётся внутри конверта и не замыкает.
Литий-ионные аккумуляторы
Эти батареи получили широкое распостранение благодаря мобильным телефонам и иным гаджетам. Сегодня же, существуют разработки и для автомобилей. Однако, невзирая на все свои достоинства, в автотехнике данный вид АКБ не прижился из-за ряда принципиальных недостатков.
Литий-ионные аккумуляторы
- Они резко теряют свою мощность из-за низкой температуры.
- Для зарядки таких батарей требуется строгое соответствие зарядному току, а это требует переделки электронной части генераторов.
- И самое главное, данные АКБ имеют стоимость в 15 раз дороже обычного кислотного аккумулятора.
Электролит
Как было указано выше, электролит представляет собой раствор серной кислоты и воды. Под действием низких температур, известно, что вода замерзает, однако с электролитом этого не происходит.
Но тем не менее она заметно загустевает и теряет свои свойства, из-за чего ёмкость батареи заметно снижается. Что бы избежать этого, сегодня, в электролит добавляют разнообразные присадки.
Гелевые электролиты
Их по праву можно считать вершиной эволюции кислотных батарей. Такие АКБ называются попросту, гелевыми. В этих устройствах электролит модифицирован настолько, что представляет собой нечто наподобие желе.
Такая модификация, в комплексе с другими вышеописанными инновациями дала поистине волшебные результаты. В итоге батареи стали практически вечными, невосприимчивыми к переворачиванию, практически не теряющими свои свойства зимой и при этом на много легче по массе.
Графен-полимерные аккумуляторы
Это, пожалуй, самые перспективные батареи для использования, как в автомобилях, оснащённых ДВС, так и электрической силовой установкой. В производстве этих АКБ использованы нанотехнологии.
Графен-полимерные аккумуляторы
Принцип работы этих поистине чудесных аккумуляторов заключается в следующем: их ёмкость, практически в три раза больше литий-ионных и при этом имеет меньшую стоимость, поскольку в их производстве не используется дорогостоящий литий. Кроме этого они не теряют своих свойств под действием низких температур.
Кроме этого они не теряют своих свойств под действием низких температур.
Основные технические характеристики аккумуляторов
Технические характеристики аккумуляторов
Номинальная емкость аккумулятора
Номинальная емкость элемента – способность накапливать и отдавать электроэнергию постоянного тока, определяет время автономной работы ИБП. Емкость электрического аккумулятора показывает время питания подключенной к нему нагрузки.
Важно! Полностью емкость не характеризует энергию аккумулятора, то есть энергию, которая может быть накоплена в полностью заряженном аккумуляторе. Чем больше напряжение аккумулятора, тем больше накопленная в нем энергия.
Емкость всегда указывается на корпусе АКБ, а также на упаковке. Именно по этому критерию, большинство пользователей выбирают нужную модель.
Пусковой ток
Это величину, характеризующая параметр тока, который протекает в стартере автомобиля в момент пуска силового узла. Пусковой или стартерный ток возникает в тот момент, когда в замке зажигания поворачивается ключ и начинает проворачиваться стартер. Единица измерения величины – Ампер. Тот же ток холодной прокрутки является показателем поведения аккумулятора в морозную погоду и сможет запускать двигатель при минусовых показателях. Определяется мощностью тока, которую батарея может выдать в течение первых 30 секунд при температуре -18°С. При высоких показателях пускового тока увеличиваются шансы завести машину при минусовой температуре.
Пусковой или стартерный ток возникает в тот момент, когда в замке зажигания поворачивается ключ и начинает проворачиваться стартер. Единица измерения величины – Ампер. Тот же ток холодной прокрутки является показателем поведения аккумулятора в морозную погоду и сможет запускать двигатель при минусовых показателях. Определяется мощностью тока, которую батарея может выдать в течение первых 30 секунд при температуре -18°С. При высоких показателях пускового тока увеличиваются шансы завести машину при минусовой температуре.
Полярность
Порядок расположения на крышке аккумулятора присоединительных клемм, которые являются токовыводящими соединительными элементами, называется полярностью. Имеет два полюса – положительный и отрицательный и варианты расположения – прямое и обратное.
Прямая полярность – отечественная разработка. Дла ее определения нужно повернуть аккумулятор таким образом, чтобы этикетка была перед глазами. При расположении плюсовой клеммы слева, а минусовой справа, можно утверждать, что АКБ с прямой полярностью.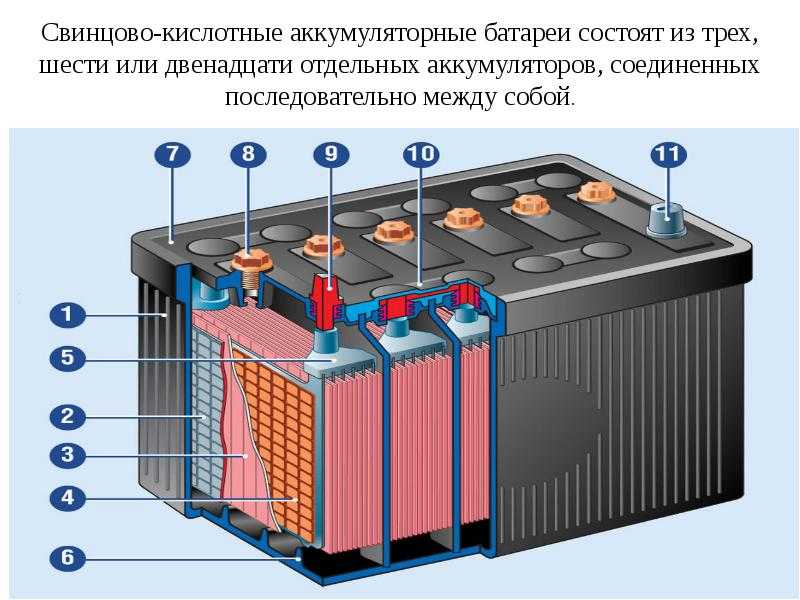 На иномарках устанавливаются аккумуляторные батареи обратной полярности.
На иномарках устанавливаются аккумуляторные батареи обратной полярности.
Прямая и обратная полярность АКБ
Устройство корпуса
У большинства аккумуляторов корпус состоит из ударопрочного полипропилена. Он характеризуется как легкий материал, не вступающий в химическую реакцию с агрессивным электролитом АКБ. Полипропилен имеет весьма хорошую стойкость к перепадам температур, возникающих под капотом автомобиля, где нагрев может достигать до +60 ̊С, а при морозах до -30°С. Корпус большинства АКБ состоит из ручки для переноса, пробок, индикатора заряда, клемм для подключения к электросети. Вес АКБ емкостью 55Ач около 16,5 кг. Известными типами аккумуляторов, обладающих спросом являются: американский, европейский, азиатский и российский типы корпусов.
Европейский тип корпуса характерен тем, что АКБ клеммы находятся в углублении, их верхний край не выступает над плоскостью крышки. В некоторых случаях клеммы дополнительно защищаются от внешнего воздействия специальными крышечками.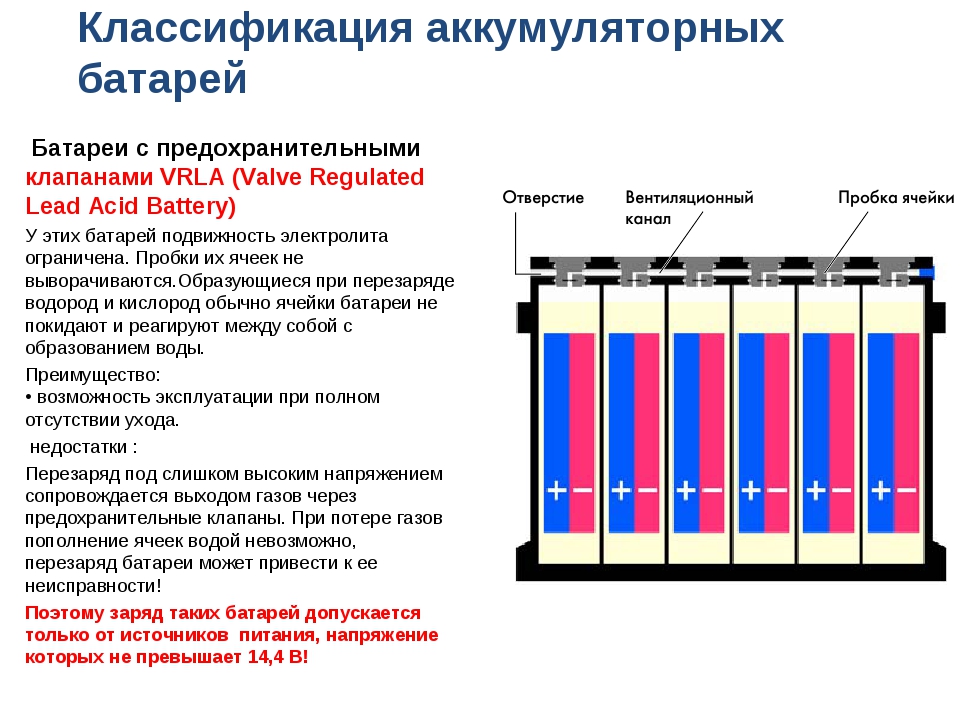 Азиатский тип корпуса – это коробка, на которой клеммы расположились на верхней крышке. Верхний край клемм является самой высокой точкой аккумулятора.
Азиатский тип корпуса – это коробка, на которой клеммы расположились на верхней крышке. Верхний край клемм является самой высокой точкой аккумулятора.
Российский стандарт АКБ
| Обозначение | Описание букв |
| А | АКБ имеет общую крышку для всего корпуса |
| З | Корпус батареи залит и она является полностью заряженной изначально |
| Э | Корпус-моноблок АКБ выполнен из эбонита |
| Т | Корпус-моноблок АБК выполнен из термопластика |
| М | В корпусе использованы сепараторы типа минпласта из ПВХ |
| П | В конструкции использованы полиэтиленовые сепараторы-конверты |
Аккумулятор (АКБ) ALPHALINE 60 Ач
Тип крепления аккумулятора
Особое внимание при выборе АКБ следует уделять типу крепления АКБ, при котором батарея может крепиться снизу или сверху. С помощью специальной монтажной рамки, которая охватывает аккумулятор, элемент крепится вверху. Крепление аккумулятора происходит с помощью планки и двух шпилек. Чаще всего такой вид установки и фиксации аккумуляторной батареи встречается на автомобилях китайского или корейского производства.
С помощью специальной монтажной рамки, которая охватывает аккумулятор, элемент крепится вверху. Крепление аккумулятора происходит с помощью планки и двух шпилек. Чаще всего такой вид установки и фиксации аккумуляторной батареи встречается на автомобилях китайского или корейского производства.
Тип крепления на АКБ
Нижнее крепление применимо на европейских автомобилях. На нижней части корпуса АКБ находится выступ. За этот выступ аккумулятор прижимается к платформе с помощью пластины и винта.
Выступ для фиксации АКБ
Заключение
Теперь вы знаете, как работает аккумулятор. Его роль в работе приборов трудно оспорить. Данный источник энергии применяться почти во всех отраслях. Что доказывает его значимость и необходимость знаний о принципе работы АКБ. А также ее внутреннем содержимом. Аккумуляторы широко используются в автомобилях, разнообразных электроприборах, кондиционерах, мультимедийных центрах. Там, где, генераторы не всегда справляются с обеспечением их энергией. И тогда в «игру» вступает АКБ, которая кроме подпитки энергией еще и выполняет основную функцию, обеспечивая электроэнергией стартер двигателя. Водителю необходимо знать, как устроен аккумулятор. Ведь в нужное время придется устранять сбои в работе источника энергии. К тому же, важно иметь представление о назначении и видах аккумулятора, чтобы правильно использовать ресурс, подобрать батарею к условиям эксплуатации и автомобилю.
Водителю необходимо знать, как устроен аккумулятор. Ведь в нужное время придется устранять сбои в работе источника энергии. К тому же, важно иметь представление о назначении и видах аккумулятора, чтобы правильно использовать ресурс, подобрать батарею к условиям эксплуатации и автомобилю.
Как работает аккумулятор (АКБ)
Как работает батарея — Любопытно
Представьте себе мир без батареек. Все те портативные устройства, от которых мы так зависим, были бы такими ограниченными! Мы смогли бы донести наши ноутбуки и телефоны только до предела досягаемости их кабелей, что сделало бы это новое работающее приложение, которое вы только что загрузили на свой телефон, довольно бесполезным.
К счастью, у нас есть батарейки. Еще в 150 г. до н.э. в Месопотамии парфянская культура использовала устройство, известное как багдадская батарея, сделанное из медных и железных электродов с уксусом или лимонной кислотой. Археологи считают, что на самом деле это не были батареи, а использовались в основном для религиозных церемоний.
Изобретение батареи в том виде, в каком мы ее знаем, приписывают итальянскому ученому Алессандро Вольта, который собрал первую батарею, чтобы доказать точку зрения другого итальянского ученого, Луиджи Гальвани. В 1780 году Гальвани показал, что лапки лягушек, подвешенных на железных или латунных крючках, будут дергаться при прикосновении к ним зондом из какого-либо другого металла. Он считал, что это было вызвано электричеством из тканей лягушек, и называл это «животным электричеством».
Луиджи Гальвани обнаружил, что лапки лягушек, подвешенных на латунных крючках, дергались, если их проткнуть зондом из другого металла. Он думал, что эта реакция была вызвана «животным электричеством» внутри лягушки. Источник изображения: Луиджи Гальвани / Wikimedia Commons.
Вольта, поначалу впечатленный открытиями Гальвани, пришел к выводу, что электрический ток исходит из двух разных типов металла (крючков, на которых висят лягушки, и другого металла зонда) и просто передается через них, а не через них.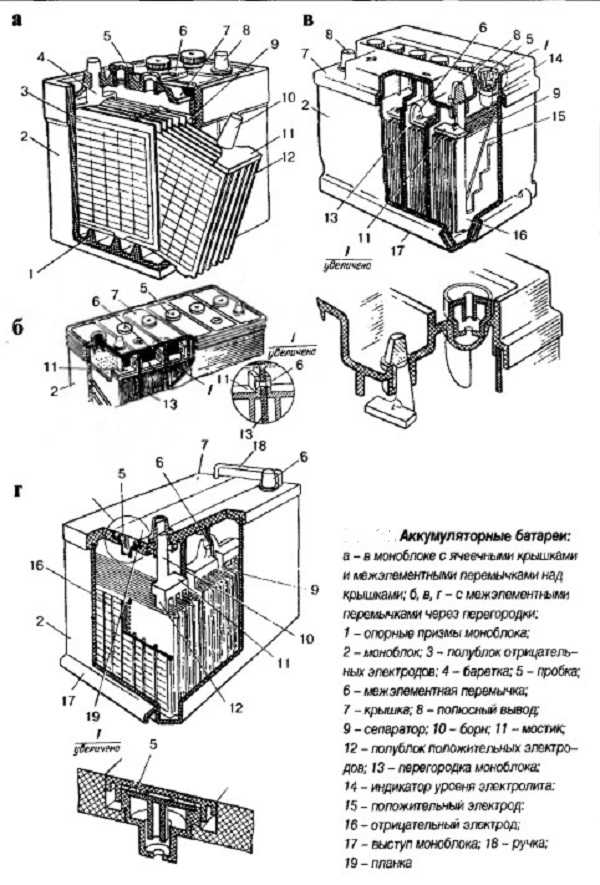 из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
из тканей лягушек. Он экспериментировал со стопками слоев серебра и цинка, перемежаемых слоями ткани или бумаги, пропитанными соленой водой, и обнаружил, что электрический ток действительно протекал по проводу, прикрепленному к обоим концам стопки.
Батарея Алессандро Вольта: груда цинковых и серебряных листов с вкраплениями ткани или бумаги, пропитанной соленой водой. Представьте, что вы используете это для питания вашего телефона. Источник изображения: Луиджи Кьеза / Wikimedia Commons.
Вольта также обнаружил, что, используя различные металлы в куче, можно увеличить величину напряжения. Он описал свои открытия в письме Джозефу Бэнксу, тогдашнему президенту Лондонского королевского общества, в 1800 году. ‘ (мера электрического потенциала) названа в его честь.
Я сам, если не считать шуток, поражаюсь тому, как мои старые и новые открытия… чистого и простого электричества, вызываемого контактом металлов, могли вызвать такой ажиотаж.Алессандро Вольта
Так что же именно происходило с этими слоями цинка и серебра и с дергающимися лягушачьими лапками?
Химия батареи
Батарея представляет собой устройство, которое накапливает химическую энергию и преобразует ее в электричество. Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Это известно как электрохимия, а система, которая лежит в основе батареи, называется электрохимической ячейкой. Батарея может состоять из одного или нескольких (как в исходной куче Вольты) электрохимических элементов. Каждая электрохимическая ячейка состоит из двух электродов, разделенных электролитом.
Так откуда электрохимический элемент получает электричество? Чтобы ответить на этот вопрос, нам нужно знать, что такое электричество. Проще говоря, электричество — это тип энергии, производимый потоком электронов. В электрохимической ячейке электроны образуются в результате химической реакции, которая происходит на одном электроде (подробнее об электродах ниже!), а затем перетекают на другой электрод, где они расходуются. Чтобы понять это правильно, нам нужно поближе взглянуть на компоненты клетки и на то, как они собираются вместе.
Электроды
Чтобы создать поток электронов, вам нужно где-то, чтобы электроны текли из , и куда-то, чтобы электроны текли в . Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
Это электроды клетки. Электроны текут от одного электрода, называемого анодом (или отрицательным электродом), к другому электроду, называемому катодом (положительный электрод). Как правило, это различные типы металлов или других химических соединений.
В батарее Вольта анодом был цинк, от которого электроны текли по проводу (при подключении) к серебру, которое было катодом батареи. Он сложил множество этих элементов вместе, чтобы сделать общую кучу и поднять напряжение.
Но откуда анод получает все эти электроны? И почему они так счастливы, что их весело отправляют на катод? Все сводится к химии, которая происходит внутри клетки.
Происходит несколько химических реакций, которые нам нужно понять. На аноде электрод вступает в реакцию с электролитом, в результате которой образуются электроны. Эти электроны накапливаются на аноде. Тем временем на катоде одновременно происходит другая химическая реакция, которая позволяет этому электроду принимать электроны.
Технический химический термин для реакции, включающей обмен электронами, представляет собой реакцию восстановления-окисления, чаще называемую окислительно-восстановительной реакцией. Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Всю реакцию можно разделить на две полуреакции, а в случае электрохимической ячейки одна полуреакция происходит на аноде, другая на катоде. Восстановление — это присоединение электронов, и это то, что происходит на катоде; мы говорим, что катод восстанавливается в ходе реакции. Окисление — это потеря электронов, поэтому мы говорим, что анод окисляется.
Каждая из этих реакций имеет определенный стандартный потенциал. Думайте об этой характеристике как о способности/эффективности реакции либо производить, либо поглощать электроны — ее сила в перетягивании каната электронами.
- Стандартные потенциалы для полуреакций
Ниже приведен список полуреакций, которые включают высвобождение электронов либо из чистого элемента, либо из химического соединения. Рядом с реакцией указано число (E 0 ), которое сравнивает силу электрохимического потенциала реакции с силой готовности водорода расстаться со своим электроном (если вы посмотрите вниз по списку, вы увидите, что водородная полуреакция имеет Е 0 нуля).
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах.Причина, по которой этот список настолько интересен, заключается в том, что если вы выберете две реакции из списка и объедините их для создания электрохимической ячейки, значения E 0 подскажут вам, каким образом будет протекать общая реакция: реакция с более отрицательное значение E 0 пожертвует свои электроны другой реакции, и это определяет анод и катод вашей ячейки. Разница между двумя значениями E 0 говорит вам об электрохимическом потенциале вашей ячейки, который в основном является напряжением ячейки.
Итак, если вы возьмете литий и фтор и сумеете соединить их, чтобы сделать элемент батареи, вы получите максимальное напряжение, теоретически достижимое для гальванического элемента. Этот список также объясняет, почему в куче Вольта цинк был анодом, а серебро катодом: полуреакция цинка имеет более низкое (более отрицательное) значение E 0 (-0,7618), чем полуреакция серебра (0,7996).
 .
.Стандартные потенциалы полуреакций восстановления
(по отношению к стандартному водородному электроду при 25°C)
В° (В) Li + (водный) + e − Li(s) –3,040 Be 2+ (водн.) + 2e − Be(s) –1,99 Al 3+ (водн.) + 3e − Al(s) –1,676 Zn 2+ (водный) + 2e − Zn(s) –0,7618 Ag 2 S(s) + 2e − 2Ag(s) + S 2− (водн.) –0,71 Fe 2+ (водн.) + 2e − Fe(s) –0,44 Cr 3+ (водн.) + e − Cr 2+ (водн.) –0,424 Cd 2+ (водн.) + 2e − Cd(s) –0,4030 PbSO 4 (т) + 2e − Pb(т) + SO 4 2− (водн.  )
)–0,356 Ni 2+ (водн.) + 2e − Ni(s) –0,257 2SO 4 2− (водн.) + 4H + (водн.) + 2e − S 2 O 6 − 290940048 (водн.) + 2H 2 O(л) –0,25 Sn 2+ (водн.) + 2e − Sn(s) −0,14 2H + (водн.) + 2e − H 2 (г) 0 Sn 4+ (водн.) + 2e − Sn 2+ (водн.) 0,154 Cu 2+ (водн.) + e − Cu + (водный) 0,159 AgCl(s) + e − Ag(s) + Cl − (водн.) 0,2223 Cu 2+ (водн.) + 2e − Cu(s) 0,3419 O 2 (г) + 2H 2 O(ж) + 4e − 4OH − (водн.  )
)0,401 H 2 SO 3 (водн.) + 4H + (водн.) + 4e − S(т) + 3H 2 O(л) 0,45 I 2 (s) + 2e − 2I − (aq) 0,5355 MnO 4 2− (водн.) + 2H 2 O(ж) + 2e − MnO 2 (тв) + 4OH − 906 0,6 O 2 (г) + 2H + (водн.) + 2e − H 2 O 2 (водный) 0,695 H 2 SeO 3 (водн.) + 4H + + 4e − Se(s) + 3H 2 O(ж) 0,74 Fe 3+ (водн.) + e − Fe 2+ (водн.) 0,771 Ag + (водный) + e − Ag(s) 0,7996 NO 3 − (водн.  ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)0,94 Br 2 (водн.) + 2e − 2Br − (водн.) 1,087 MnO 2 (т) + 4H + (водн.) + 2e − Mn 2+ (водн.) + 2H 2 O(л) 1,23 О 2 (г) + 4H + (водн.) + 4e − 2H 2 O(л) 1,229 CR 2 O 7 2- (AQ) + 14H + (AQ) + 6E — 2CR 3+ (AQ) + 7H 2 2 333333333333333. (AQ) + 7H 2 2 3333333333333333333333. 3+ (AQ) + 7H 2 2 33333333333. 3+ (AQ) + — 2 3+ (AQ) + — 2 3+ (AQ).
1,36 Cl 2 (г) + 2e − 2Cl − (водн.  )
)1,396 Се 4+ (водн.)+е − Се 3+ (водный) 1,44 PBO 2 (S) + HSO 4 — (AQ) + 3H + (AQ) + 2E — PBSO 4 (S) + 2H 2H 3 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H1233 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2H123 2. 1,69 H 2 O 2 (водн.) + 2H + (водн.) + 2e − 2H 2 O(л) 1,763 F 2 (г) + 2e − 2F − (водный) 2,87 Источник: UC Davis ChemWiki
Любые два проводящих материала, вступающих в реакции с разными стандартными потенциалами, могут образовать электрохимическую ячейку, потому что более сильный сможет отбирать электроны у более слабого. Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Но идеальным выбором для анода был бы материал, который вызывает реакцию со значительно более низким (более отрицательным) стандартным потенциалом, чем материал, который вы выбрали для своего катода. В итоге мы получаем, что электроны притягиваются к катоду от анода (и анод не пытается сильно сопротивляться), и когда у нас есть легкий путь туда — проводящий провод — мы можем использовать их энергию для обеспечения электрического тока. питание на фонарик, телефон или что-то еще.
Разница в стандартном потенциале между электродами примерно равна силе, с которой электроны перемещаются между двумя электродами. Это известно как общий электрохимический потенциал ячейки, и он определяет напряжение ячейки. Чем больше разница, тем больше электрохимический потенциал и выше напряжение.
Чтобы увеличить напряжение батареи, у нас есть два варианта. Мы могли бы выбрать разные материалы для наших электродов, которые придадут клетке больший электрохимический потенциал. Или мы можем сложить несколько ячеек вместе. Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда элементы объединены определенным образом (последовательно), это оказывает аддитивное влияние на напряжение батареи. По сути, силу, с которой электроны движутся через батарею, можно рассматривать как общую силу, когда они движутся от анода первой ячейки через все ячейки, содержащиеся в батарее, к катоду последней ячейки.
Когда ячейки объединены другим способом (параллельно), это увеличивает возможный ток батареи, который можно рассматривать как общее количество электронов, протекающих через ячейки, но не как их напряжение.
Электролит
Но электроды — это только часть батареи. Помните бумажки Вольта, смоченные в соленой воде? Соленая вода была электролитом, еще одной важной частью картины. Электролит может быть жидкостью, гелем или твердым веществом, но он должен обеспечивать движение заряженных ионов.
Электроны имеют отрицательный заряд, и, поскольку мы посылаем поток отрицательных электронов по нашей цепи, нам нужен способ сбалансировать движение этого заряда. Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Электролит обеспечивает среду, через которую могут протекать положительные ионы, уравновешивающие заряд.
Поскольку химическая реакция на аноде приводит к образованию электронов, для поддержания баланса нейтрального заряда на электроде также производится соответствующее количество положительно заряженных ионов. Они не идут по внешнему проводу (это только для электронов!), а выбрасываются в электролит.
В то же время катод также должен уравновешивать отрицательный заряд электронов, которые он получает, поэтому происходящая здесь реакция должна втягивать положительно заряженные ионы из электролита (в качестве альтернативы она может также высвобождать отрицательно заряженные ионы из электрода в электролит).
Таким образом, в то время как внешний провод обеспечивает путь для потока отрицательно заряженных электронов, электролит обеспечивает путь для передачи положительно заряженных ионов, чтобы сбалансировать отрицательный поток. Этот поток положительно заряженных ионов столь же важен, как и электроны, обеспечивающие электрический ток во внешней цепи, которую мы используем для питания наших устройств.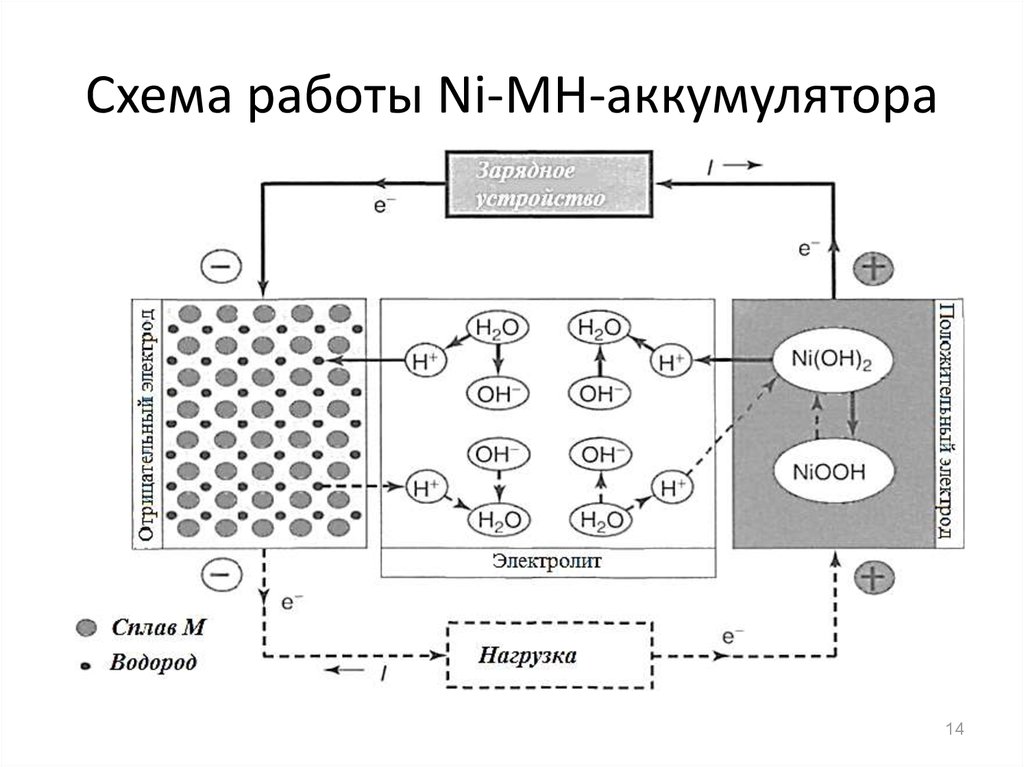 Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Роль балансировки заряда, которую они выполняют, необходима для поддержания всей реакции.
Теперь, если позволить всем ионам, выпущенным в электролит, полностью свободно перемещаться через электролит, они закончат тем, что покроют поверхности электродов и засорят всю систему. Таким образом, у клетки обычно есть какой-то барьер, чтобы предотвратить это.
Показывать метки во время анимации
Начать анимацию
При использовании батареи возникает ситуация, при которой происходит непрерывный поток электронов (через внешнюю цепь) и положительно заряженных ионов (через электролит). Если этот непрерывный поток остановлен — если цепь разомкнута, например, когда ваш фонарик выключен — поток электронов остановится. Заряды будут накапливаться, и химические реакции, управляющие батареей, прекратятся.
По мере использования батареи и протекания реакций на обоих электродах производятся новые химические продукты. Эти продукты реакции могут создать своего рода сопротивление, которое может помешать протеканию реакции с той же эффективностью. Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Когда это сопротивление становится слишком большим, реакция замедляется. Электронное перетягивание каната между катодом и анодом также теряет свою силу, и поток электронов прекращается. Аккумулятор медленно садится.
Зарядка аккумулятора
Некоторые распространенные батареи предназначены только для одноразового использования (известные как первичные или одноразовые батареи). Путешествие электронов от анода к катоду является односторонним. Либо их электроды истощаются, когда они выделяют свои положительные или отрицательные ионы в электролит, либо накопление продуктов реакции на электродах препятствует продолжению реакции, и дело сделано и запылено. Аккумулятор попадает в мусорное ведро (или, надеюсь, на переработку, но это совсем другая тема Nova).
Но. Преимущество этого потока ионов и электронов в том, что он имеет место в некоторых типах батарей с соответствующими материалами электродов, заключается в том, что он также может двигаться в обратном направлении, возвращая нашу батарею в исходную точку и давая ей совершенно новую жизнь. . Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
. Точно так же, как батареи изменили то, как мы можем использовать различные электрические устройства, перезаряжаемые батареи еще больше изменили полезность и срок службы этих устройств.
Когда мы подключаем почти разряженную батарею к внешнему источнику электроэнергии и отправляем энергию обратно в батарею, она обращает вспять химическую реакцию, которая произошла во время разряда. Это отправляет положительные ионы, выпущенные из анода в электролит, обратно к аноду, а электроны, которые принял катод, также возвращаются к аноду. Возвращение как положительных ионов, так и электронов обратно в анод запускает систему, поэтому она снова готова к работе: ваша батарея перезаряжена.
Показывать метки во время анимации
Начать анимацию
Однако процесс не идеален. Замена отрицательных и положительных ионов из электролита обратно на соответствующий электрод по мере перезарядки батареи происходит не так аккуратно и красиво, как электрод изначально. Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
Каждый цикл зарядки ухудшает состояние электродов еще немного, а это означает, что батарея со временем теряет производительность, поэтому даже перезаряжаемые батареи не могут работать вечно.
В течение нескольких циклов зарядки и разрядки форма кристаллов батареи становится менее упорядоченной. Это усугубляется, когда батарея разряжается/перезаряжается с высокой скоростью, например, если вы едете на своем электромобиле большими рывками, а не постоянно. Циклирование с высокой скоростью приводит к тому, что кристаллическая структура становится более неупорядоченной, в результате чего батарея становится менее эффективной.
Эффект памяти и саморазряд
Почти полностью обратимые реакции разрядки и перезарядки также способствуют так называемому «эффекту памяти». Когда вы перезаряжаете некоторые типы перезаряжаемых батарей, предварительно не разрядив их в достаточной степени, они «вспоминают», на каком уровне они были в предыдущих циклах разрядки, и не заряжаются должным образом.
В некоторых элементах это вызвано тем, как металл и электролит реагируют с образованием соли (и тем, как соль затем снова растворяется, а металл заменяется на электродах при перезарядке). Мы хотим, чтобы наши клетки имели красивые, однородные маленькие кристаллы соли, покрывающие идеальную металлическую поверхность, но это не то, что мы получаем в реальном мире! Способ формирования некоторых кристаллов очень сложен, и способ осаждения некоторых металлов во время перезарядки также удивительно сложен, поэтому некоторые типы батарей имеют больший эффект памяти, чем другие. Несовершенства в основном зависят от состояния заряда батареи, температуры, зарядного напряжения и зарядного тока. Со временем недостатки в одном цикле зарядки могут вызвать то же самое в следующем цикле зарядки и т. д., и наша батарея накапливает некоторые плохие воспоминания. Эффект памяти силен для некоторых типов элементов, таких как батареи на основе никеля. Другие типы, такие как литий-ионные, не страдают от этой проблемы.
Еще один аспект перезаряжаемых батарей заключается в том, что химический состав, делающий их перезаряжаемыми, также означает, что они имеют более высокую склонность к саморазряду. Это когда внутри элемента батареи происходят внутренние реакции, даже когда электроды не подключены через внешнюю цепь. Это приводит к тому, что клетка со временем теряет часть своей химической энергии. Высокая скорость саморазряда серьезно ограничивает срок службы батареи и заставляет ее умирать при хранении.
Литий-ионные аккумуляторы в наших мобильных телефонах имеют довольно хорошую скорость саморазряда, около 2–3 % в месяц, и наши свинцово-кислотные автомобильные аккумуляторы также довольно разумны — они имеют тенденцию терять 4–6 %. в месяц. Аккумуляторы на основе никеля теряют около 10–15 процентов своего заряда в месяц, что не очень хорошо, если вы планируете хранить фонарь целый сезон, когда он вам не нужен! Неперезаряжаемая щелочная батарея теряет всего около 2–3 процентов своего заряда в год.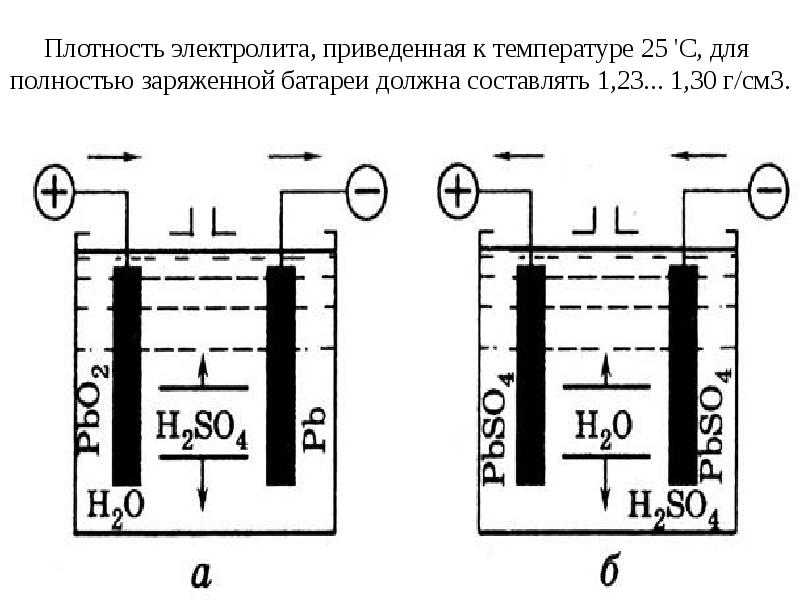
Напряжение, ток, мощность, мощность… в чем разница?
Все эти слова в основном описывают мощность батареи, верно? Ну вроде. Но все они немного разные.
Напряжение = сила, при которой реакция, приводящая в движение батарею, проталкивает электроны через ячейку. Это также известно как электрический потенциал и зависит от разности потенциалов между реакциями, происходящими на каждом из электродов, то есть от того, насколько сильно катод будет тянуть электроны (через цепь) от анода. Чем выше напряжение, тем большую работу может совершить одно и то же число электронов.
Ток = количество электронов, проходящих через любую точку цепи в данный момент времени. Чем больше сила тока, тем больше работы он может совершить при том же напряжении. Внутри ячейки вы также можете думать о токе как о количестве ионов, движущихся через электролит, умноженном на заряд этих ионов.
Мощность = напряжение x ток. Чем выше мощность, тем выше скорость, с которой батарея может работать — это соотношение показывает, насколько важны напряжение и ток для определения того, для чего подходит батарея.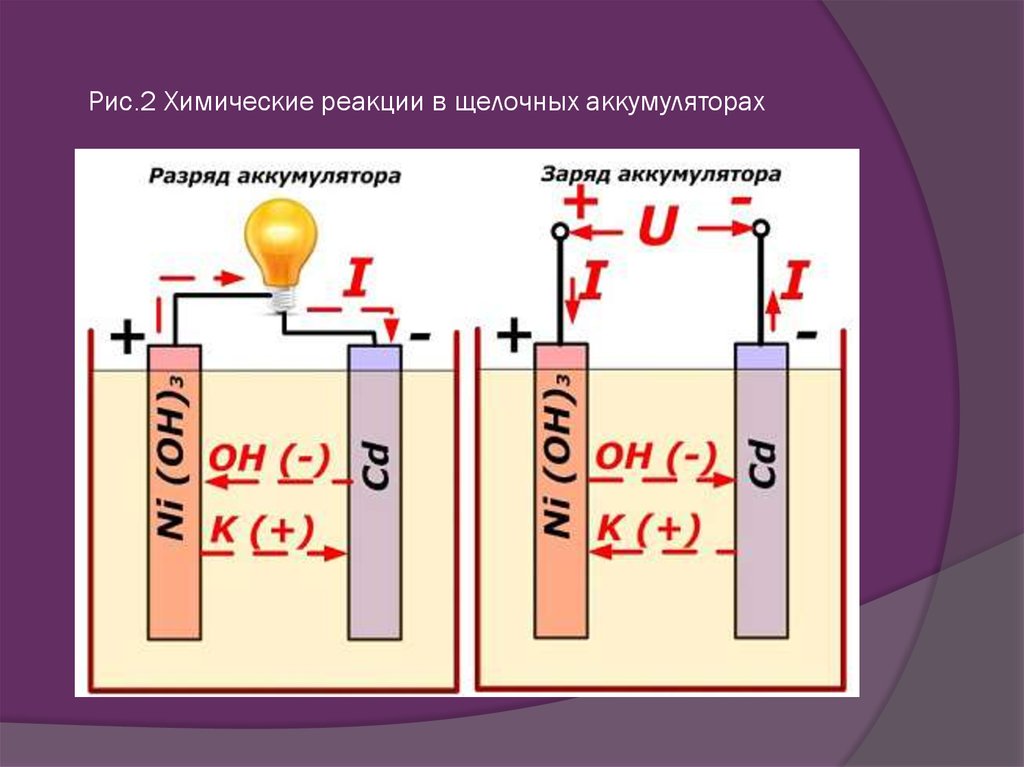
Емкость = мощность батареи как функция времени, которая используется для описания периода времени, в течение которого батарея сможет питать устройство. Аккумулятор большой емкости сможет работать в течение более длительного периода, прежде чем разрядится или разрядится. У некоторых аккумуляторов есть небольшая грустная особенность: если вы попытаетесь извлечь из них слишком много слишком быстро, вовлеченные химические реакции не смогут продолжаться, и емкость уменьшится! Таким образом, мы всегда должны быть осторожны, когда говорим о емкости батареи и помнить, для чего она будет использоваться.
Другой популярный термин — «плотность энергии». Это количество энергии, которое устройство может удерживать на единицу объема, другими словами, какую отдачу вы получаете за свои деньги с точки зрения мощности и размера. С аккумулятором, как правило, чем выше плотность энергии, тем лучше, так как это означает, что аккумулятор может быть меньше и компактнее, что всегда является плюсом, когда он нужен для питания чего-то, что вы хотите держать в кармане.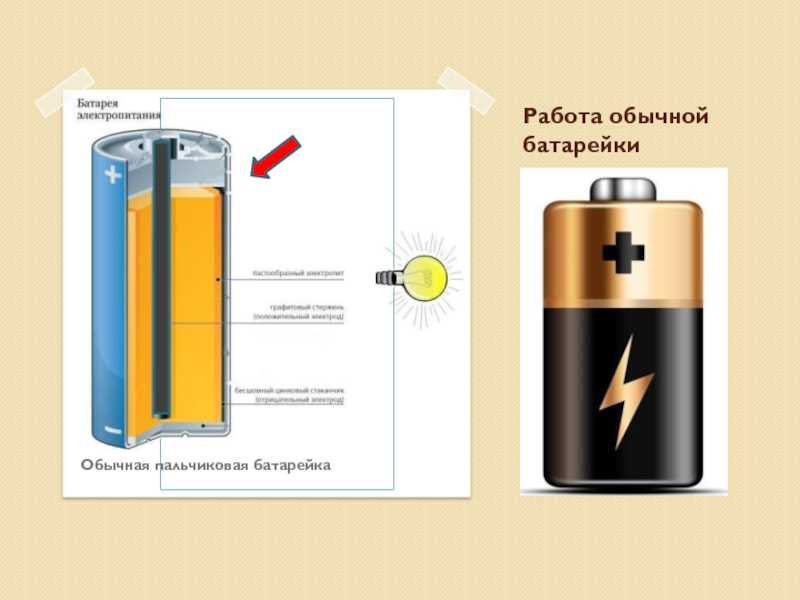 Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для электромобилей это даже плюс — аккумулятор должен как-то влезать в машину!
Для некоторых приложений, таких как хранение электроэнергии на возобновляемой электростанции, такой как ветряная или солнечная электростанция, высокая плотность энергии не является большой проблемой, так как у них, скорее всего, будет достаточно места для хранения батарей. Основной целью такого использования было бы просто хранить как можно больше электроэнергии, как можно безопаснее и дешевле.
Видео: Как работают аккумуляторы? (TED-Ed/YouTube). Посмотреть подробности и расшифровку.
Почему так много типов?
Ряд материалов (раньше это были просто металлы) можно использовать в качестве электродов в батарее. За прошедшие годы было опробовано много-много различных комбинаций, но лишь немногие из них действительно прошли дистанцию. Но зачем вообще использовать разные комбинации металлов? Если у вас есть пара металлов, которые хорошо работают вместе в качестве электродов, зачем возиться с другими?
Различные материалы имеют разные электрохимические свойства, поэтому они дают разные результаты, когда вы кладете их вместе в элемент батареи. Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Например, некоторые комбинации будут создавать высокое напряжение очень быстро, но затем быстро падать, не в состоянии поддерживать это напряжение в течение длительного времени. Это хорошо, если вам нужно произвести, скажем, внезапную вспышку света, как вспышка фотокамеры.
Другие комбинации дадут лишь струйку тока, но они будут поддерживать эту струйку на века. Например, нам не нужно большое количество тока для питания детектора дыма, но мы хотим, чтобы наши детекторы дыма работали долгое время.
Еще одна причина для использования различных комбинаций металлов заключается в том, что часто для получения требуемого напряжения необходимо сложить два или более элемента батареи, и оказывается, что некоторые комбинации электродов складываются вместе гораздо лучше, чем другие комбинации. Например, литий-железо-фосфатные батареи (разновидность литий-ионных батарей), используемые в электромобилях, объединяются вместе для создания систем высокого напряжения (100 и даже более вольт), но вы никогда не сделаете этого с теми никель-кадмиевыми батареями Walkman, которые получают горячий!
Наши различные потребности со временем привели к разработке огромного количества типов батарей. Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Чтобы узнать больше о них и о том, что ждет аккумулятор в будущем, ознакомьтесь с другими нашими темами Nova.
Эта тема является частью нашей серии статей о батареях, состоящей из четырех частей. Для дальнейшего чтения см. Типы аккумуляторов, литий-ионные аккумуляторы и аккумуляторы будущего.
Как работают батареи — принцип работы, хранение и старение — батарея Greenway
0769-27282088
Сервисный центр
Dongguan Greenway Battery Co., Ltd.
ФАКС:(+86) 769 2229 0098
粤ICP备11070025号
Эл.
Аккумулятор представляет собой устройство, которое накапливает энергию в виде химического вещества и при необходимости преобразует ее в электрическую энергию. А это обычные батарейки — те, что очень знакомой цилиндрической формы. Не существует батареи, которая хранит электрическую энергию, и каждая батарея хранит энергию в какой-то другой форме. Чтобы узнать больше о том, как работают батареи, мы рекомендуем вам продолжить чтение, чтобы узнать об этом и узнать все, что вам нужно знать о работе батареи.
Каков принцип работы батареи?
+Когда два разнородных металла, называемых электродами, помещают в разбавленный электролит, в электродах происходят реакции окисления и восстановления в зависимости от электронного контакта металла электродов. В результате реакции окисления один электрод получает отрицательный заряд, называемый катодом. Другой электрод получает положительный заряд, называемый анодом, благодаря реакции восстановления. Катод образует отрицательную клемму, а анод — положительную клемму элемента или батареи.
Чтобы понять фундаментальный принцип батареи, вам необходимо понять основную концепцию сродства к электронам. Когда два, в отличие от металлов, помещаются в электролит, между этими металлами возникает разность потенциалов.
Обнаружено, что при добавлении в воду определенных соединений они растворяются и образуют положительные и отрицательные ионы. Этот тип соединения известен как электролит. Энергия, возникающая при принятии электрона нейтральным атомом, называется сродством к электрону. Если два разных типа металлов поместить в один и тот же раствор электролита, то один получит электроны, а другой в конечном итоге отдаст электроны. И какой металл получит электроны, а какой потеряет, зависит от сродства к электрону. Металл с меньшим сродством будет приобретать электроны от -ve ионов раствора электролита.
Если два разных типа металлов поместить в один и тот же раствор электролита, то один получит электроны, а другой в конечном итоге отдаст электроны. И какой металл получит электроны, а какой потеряет, зависит от сродства к электрону. Металл с меньшим сродством будет приобретать электроны от -ve ионов раствора электролита.
С другой стороны, металл с высоким сродством к электрону в конечном итоге высвобождает электроны. Следовательно, между этими двумя металлами будет ключевая разница в концентрации электронов. Эта разница приводит к разнице электрических потенциалов, образующейся между металлами. Эту разность или ЭДС можно использовать в качестве источника напряжения в любой электрической цепи. Это общий принцип работы аккумулятора.
Как батарея сохраняет энергию?
Существует два основных типа химических аккумуляторов: перезаряжаемые или вторичные элементы, первичные элементы и неперезаряжаемые. Что касается хранения энергии, а также разрядки электричества, они идентичны. Вопрос только в том, допускают ли используемые химические процессы многократную зарядку и разрядку.
Вопрос только в том, допускают ли используемые химические процессы многократную зарядку и разрядку.
Все гальванические элементы имеют два электрода. Область между электродами заполнена электролитом — ионной жидкостью, проводящей электричество. Электрод — анод — позволяет электронам выходить из него. Другой — катод — их принимает. Энергия запасается в специальных соединениях, входящих в состав анода, катода и электролита, например, цинка, меди и SO4.
Анод подвергается реакции окисления: во время разряда два или более ионов соединяются с анодом, образуя соединение, а также высвобождают 1 или более электронов. А катод подвергается реакции восстановления, при которой материал, из которого сделан катод, образует соединения с ионами и свободными электронами.
Как умирает батарея?
Когда активное вещество в пластинах не может поддерживать поток разряда, аккумулятор «умирает». Как правило, автомобильный (или ранний) аккумулятор «стареет» по мере того, как активный материал положительной пластины осыпается (или отслаивается) из-за нормального расширения и сжатия, которые происходят во время циклов разрядки и зарядки. Это приводит к тому, что пластина теряет емкость, и коричневый осадок, называемый шламом или «грязью», накапливается на дне корпуса, а также замыкает пластину ячейки. Это повредит аккумулятор как можно быстрее.?
Это приводит к тому, что пластина теряет емкость, и коричневый осадок, называемый шламом или «грязью», накапливается на дне корпуса, а также замыкает пластину ячейки. Это повредит аккумулятор как можно быстрее.?
В жаркую погоду дополнительными причинами выхода из строя являются положительный рост решетки, повреждение металла положительной сетки, отрицательная усадка сетки, коробление пластины или потеря воды. Глубокие разряды, вибрация, нагрев, быстрая зарядка и перезарядка — все это стимулирует процесс «старения». Около 50% преждевременных отказов автомобильных аккумуляторов вызваны отсутствием технического обслуживания, испарением из-за сильного геотермального тепла или потерей воды для нормальной подзарядки из-за перезарядки. Положительный рост сетки и недозарядка, вызванная сульфатацией, могут привести к преждевременным отказам.
Срок службы батареи зависит от ее химического возраста, который превышает время после сборки батареи. Химический возраст батареи определяется сложной комбинацией нескольких факторов, включая температурную историю и режим зарядки. Все перезаряжаемые батареи годны к употреблению и химически не эффективны с возрастом. По мере химического старения литий-ионных аккумуляторов объем удерживаемого ими заряда уменьшается, сокращается срок службы аккумулятора и снижается максимальная производительность.
Все перезаряжаемые батареи годны к употреблению и химически не эффективны с возрастом. По мере химического старения литий-ионных аккумуляторов объем удерживаемого ими заряда уменьшается, сокращается срок службы аккумулятора и снижается максимальная производительность.
Заключение
Вот и все. Здесь мы рассмотрели основную идею о том, как работают батареи. Энергия запасается в специальных соединениях, из которых состоят анод, катод и электролит. Аккумулятор достигает заряженного состояния во время перезарядки или сборки устройства. Во время разряда химическое вещество на аноде высвобождает электроны, а ионы в электролите подвергаются реакции окисления. Многие электрохимические и термические процессы происходят одновременно, и даже самые практичные комбинации элементов, упакованные в виде аккумуляторов, не могут полностью отразить все процессы. Таким образом, приближение основных реакций является лишь кратким описанием того, что происходит на самом деле, но также помогает объяснить основной принцип работы батареи.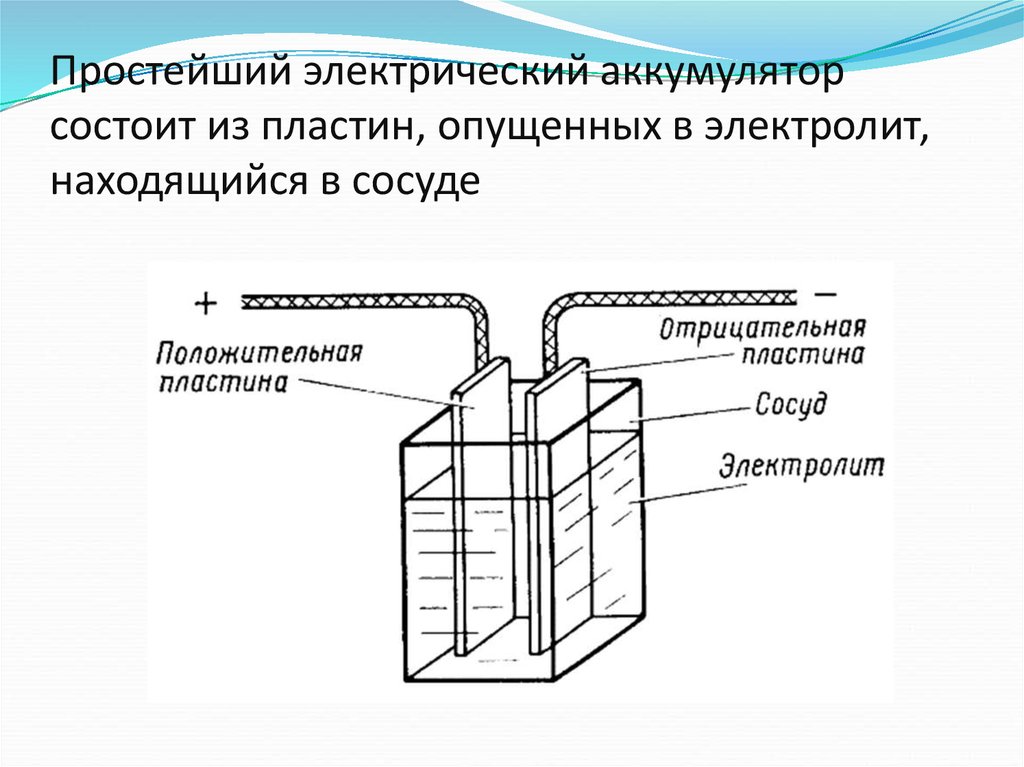

 В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ.
В них степень саморазряда значительно меньше, чем в сурьмянистых АКБ.
 E 0 измеряется в вольтах.
E 0 измеряется в вольтах.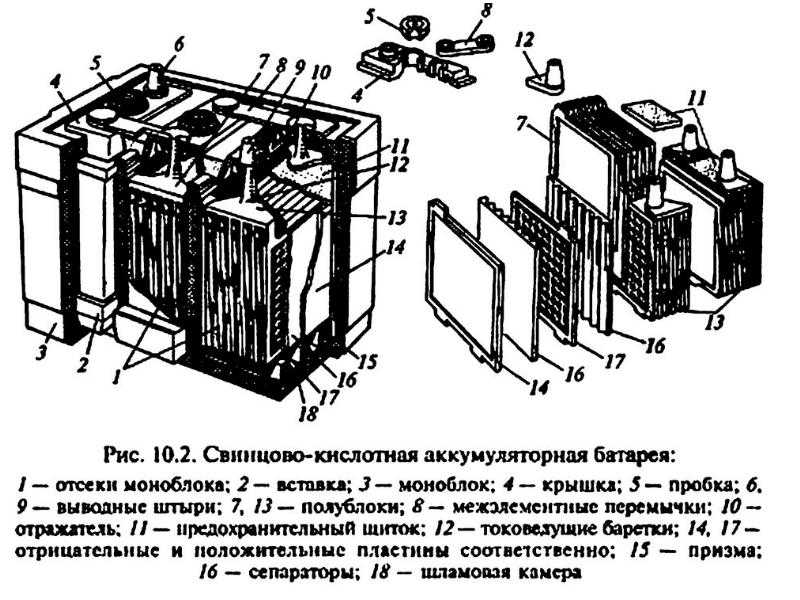 .
. )
) )
) ) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l)
) + 3H + (водн.) + 2e − HNO 2 (водн.) + H 2 O(l) )
)