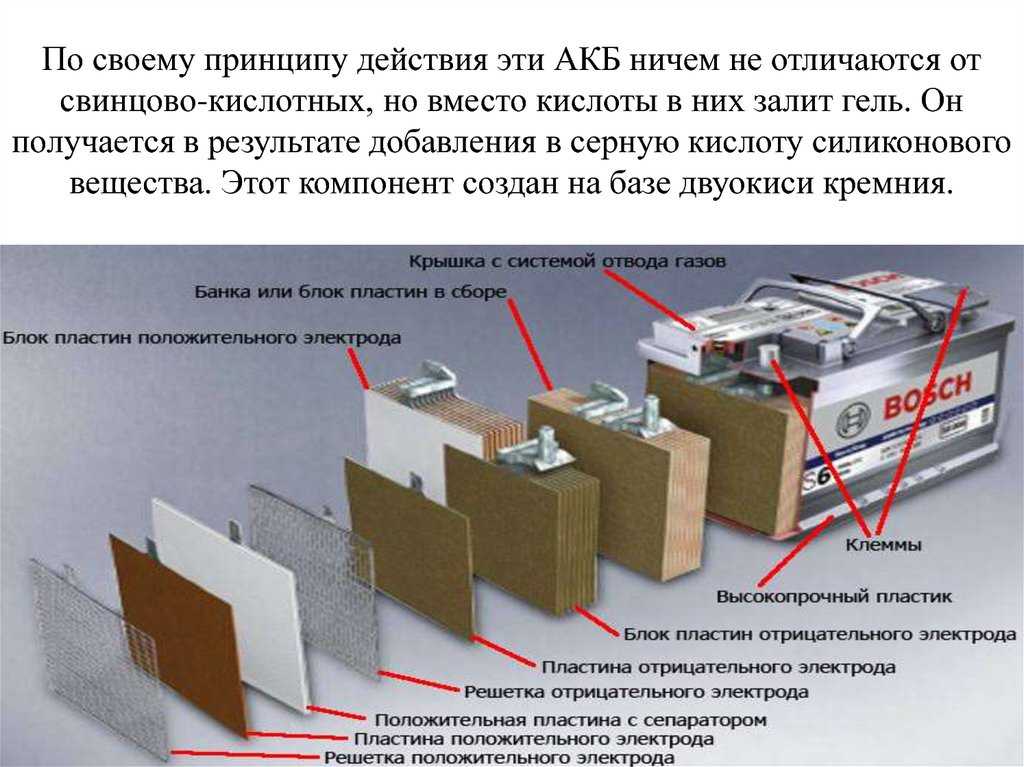
Содержание
устройство, эксплуатация, принцип работы и схема
Автономные источники электроэнергии являются одними из самых полезных изобретений человечества. Что такое телефон или радио, в которых не установлены аккумуляторные батареи? Устройство многих приспособлений, а также условия их использования не всегда предусматривают наличие постоянного сетевого электропитания, поэтому такие источники электроэнергии позволяют с комфортом осуществлять свою деятельность практически в любой точке мира. После небольшого предисловия давайте приступим к статье.
Что такое аккумуляторная батарея?
В широком смысле под этим понятием подразумевают устройство, что при одних условиях использования может накапливать какой-либо вид энергии, а при других – расходовать, чтобы удовлетворить нужды человека.
Классификация, типы и размеры батареек
В наше время батарейки являются самыми распространёнными источниками питания для электроники и…
Аккумуляторы аккумулируют электричество от внешнего источника питания, а потом отдают её подключенным потребителям, чтобы они смогли делать свою работу. Так, когда устройства работают, постоянно протекают химические реакции между электролитом и электродными пластинами. Кстати, подобная конструкция размещена в банках, из которых и формируются аккумуляторные батареи. Устройство данных конструкций предусматривает создание напряжения, как правило, 1,2-2 В, что весьма мало. Поэтому для увеличения показателей источников питания и применяются разные типы соединения.
Так, когда устройства работают, постоянно протекают химические реакции между электролитом и электродными пластинами. Кстати, подобная конструкция размещена в банках, из которых и формируются аккумуляторные батареи. Устройство данных конструкций предусматривает создание напряжения, как правило, 1,2-2 В, что весьма мало. Поэтому для увеличения показателей источников питания и применяются разные типы соединения.
Устройство данных источников питания предусматривает подключение к плюсу и минусу. Функционируют они следующим образом: когда к электродам подключается нагрузка (в качестве примера можно рассмотреть лампочку), то возникает замкнутая электрическая цепь. По ней начинает протекать ток разряда. Формируется он благодаря движению электронов, анионов и катионов. Более детальную информацию о том, что и как протекает, можно рассказать только на конкретном примере.
Литий-железо-фосфатный аккумулятор: характеристики,…
Внедрение новых типов электрооборудования в производство, ускорение технологического процесса – все.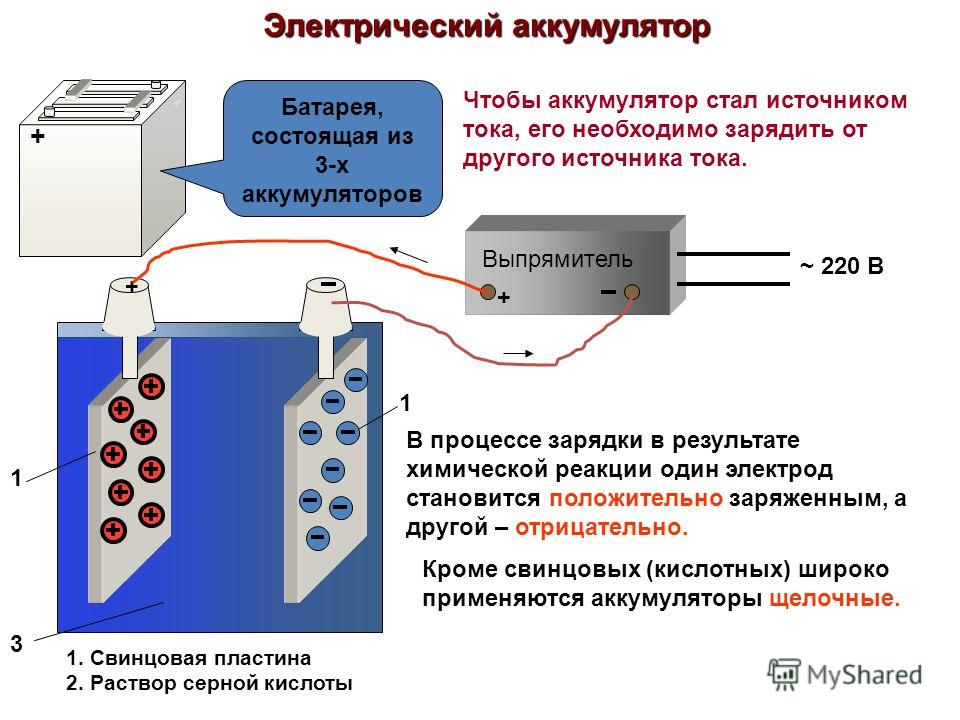 ..
..
Допустим, что у нас есть аккумулятор, где положительный электрод – это окись никеля, в который был добавлен графит для повышения проводимости. Для отрицательной пластины применяли губчатый кадмий. Так вот, когда идёт разряд, то частицы активного кислорода выделяются и попадают в электролит. При этом от них отделяются части, которые идут как электричество (те же электроны). Затем частицы активного кислорода направляются в сторону отрицательных пластин, где они окисляют кадмий.
Функционирование аккумулятора при заряде
Необходимо отключить нагрузку на клеммах пластин. На них же подаётся, как правило, постоянное напряжение (но может быть и пульсирующее, зависит от случая), которое больше, чем величина батареи, что заряжается. Причем полярность должна быть одинаковой. То есть минусовые и плюсовые клеммы потребителя и источника обязаны совпадать. Учтите, что зарядное устройство обязательно должно обладать большей мощностью, чем есть в аккумуляторе, чтобы подавлять остатки энергии в нем и создавать электрический ток, направление которого будет противоположным разряду.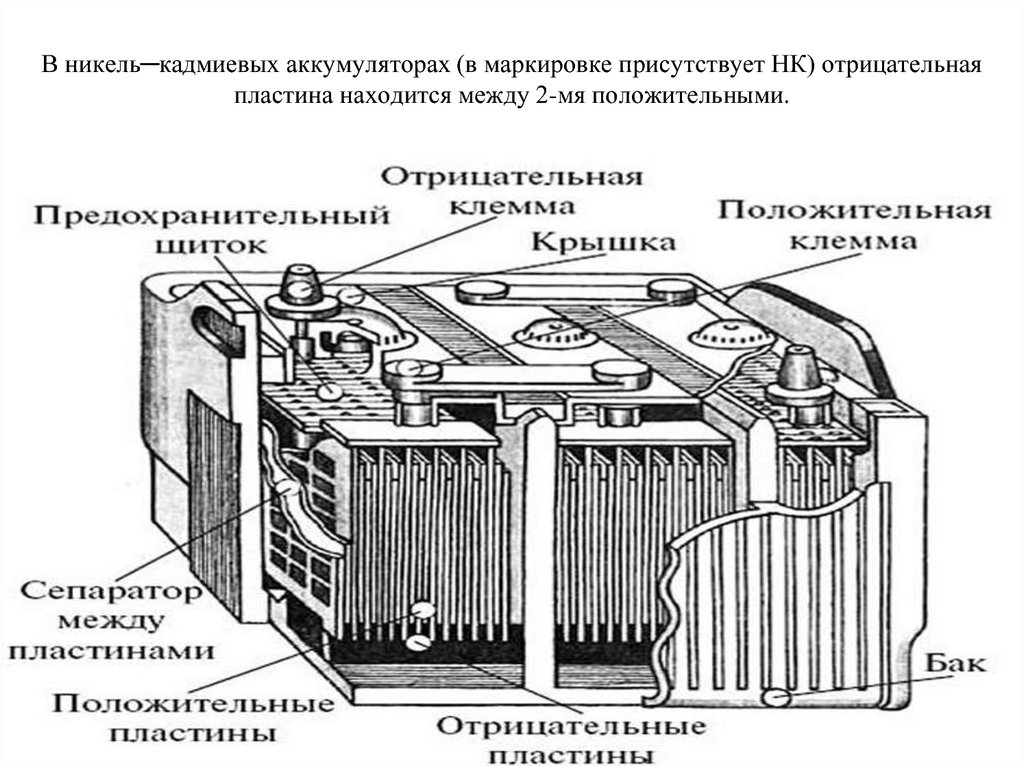 В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.
В результате меняются и химические процессы, которые протекают в аккумуляторной батарее.
Давайте рассмотрим пример из предыдущего подпункта статьи. Здесь уже положительный электрод будет обогащаться кислородом, а на отрицательном восстановится чистый кадмий. Подводя итог, можно сказать, что во время заряда и разряда меняется только химический состав электродов. Это не относится к электролиту. Но он может испаряться, что негативно будет сказываться на времени работы батареи.
Зарядка аккумулятора схема и принцип действия
Как заряжаются аккумуляторы? Как выглядит зарядка для них? По какому принципу она действует? Об…
Итак, мы рассмотрели принцип работы любого аккумулятора. Теперь давайте узнаем, как во время эксплуатации можно улучшить их характеристики.
Параллельное соединение
Величина тока зависит от значительного количества факторов. В первую очередь под этим понимают конструкцию, применяемые материалы и их габариты. Чем большую площадь имеют электроды, тем большие показатели тока они смогут выдержать. Этот принцип используется для параллельного соединения однотипных банок в аккумуляторах. Такое делается, если необходимо увеличить значение тока, что идёт на нагрузку. Но вместе с этим приходится и поднимать мощность источника энергии.
Этот принцип используется для параллельного соединения однотипных банок в аккумуляторах. Такое делается, если необходимо увеличить значение тока, что идёт на нагрузку. Но вместе с этим приходится и поднимать мощность источника энергии.
Последовательное соединение
Если рассматривать банки, из которых состоят аккумуляторные батареи, то необходимо сказать, что они находятся, как правило, в одном корпусе. Подобный тип соединения используется, чтобы получить большие показатели напряжения с меньшими потерями.
Увидеть применение этой конструкции можно, разобрав автомобильные батареи, которые являются свинцово-кислотными. Стоит сказать, что этот тип применяется не только в устройстве автомобильного аккумулятора, это просто самый вероятный способ разобрать, как же работает подобный тип соединения. В таком случае необходимо позаботится о том, чтобы не было металлического контакта, а существовала надежная гальваническая связь через электролит. Но это только нужно понимать в отношении данного типа. В других случаях по-другому будет реализовываться поставленная задача соединения.
В других случаях по-другому будет реализовываться поставленная задача соединения.
Типы аккумуляторных батарей
Они разнятся из-за своего предназначения, возможностей, реализации и материала. На данный момент современным производством освоен выпуск больше трех десятков типов, которые отличаются своим составом электродов, а также применяемым электролитом. Так, например, li-ion аккумуляторы могут похвастаться семейством из 12 известных моделей. Условно можно выделить следующие типы:
- Свинцово-кислотные.
- Литиевые.
- Никель-кадмиевые.
Это самые популярные представители. Но для понимания возможностей предлагаем ознакомиться со списком материалов, которые могут выступать в качестве электродов:
- железо;
- свинец;
- титан;
- литий;
- кадмий;
- кобальт;
- никель;
- цинк;
- ванадий;
- серебро;
- алюминий;
- ряд других элементов, которые, впрочем, встречаются очень редко.
Использование разных материалов влияет на получаемые выходные характеристики и, следовательно, на сферу применения. Так, к примеру, li-ion аккумуляторы применяются в компьютерных и мобильных устройствах. Тогда как никель-кадмиевые используются в качестве замены стандартных гальванических элементов. Теоретически все типы аккумуляторных батарей могут работать с любой нагрузкой. Вопрос только в том, насколько оправданным является такое применение.
Так, к примеру, li-ion аккумуляторы применяются в компьютерных и мобильных устройствах. Тогда как никель-кадмиевые используются в качестве замены стандартных гальванических элементов. Теоретически все типы аккумуляторных батарей могут работать с любой нагрузкой. Вопрос только в том, насколько оправданным является такое применение.
Основные характеристики
Мы уже рассмотрели, что такое аккумуляторные батареи, устройство этих конструкций, из чего их делают. Теперь давайте сосредоточимся на том, что влияет на их эксплуатацию. Важными для нас характеристиками являются:
- Плотностью называют характеристику соотношения количества энергии к объему или весу аккумулятора.
- Емкостью именуют значение максимального заряда аккумулятора, которое он может отдать во время процесса разряда, пока не будет достигнуто наименьшее напряжение. Данный показатель выражается в ампер-часах или кулонах. Также может указываться энергетическая емкость. Она измеряется в ватт-часах или джоулях.
 Задача такой емкости – сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения.
Задача такой емкости – сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения. - Температурный режим оказывает влияние на электрические свойства аккумуляторной батареи. Когда есть серьезные отклонения от рекомендованного производителем диапазона эксплуатации, то существует высокая вероятность выхода источника питания из строя. Это объясняется тем, что холод и жара влияют на интенсивность протекания химических реакций, а также на внутреннее давление.
- Саморазрядом именуют потери емкости, которые происходят после заряда батареи, когда отсутствует нагрузка на клеммах. Во многом этот показатель зависит от конструктивного исполнения и может увеличиваться, если нарушилась изоляция.
Вот такие характеристики аккумуляторных батарей и предоставляют для нас наибольший интерес. Конечно, если придётся делать что-то новое и эксклюзивное, ранее невиданное, то может понадобиться и что-то ещё. Но это весьма маловероятно.
Устройство электродов
В качестве примера мы возьмём свинцовые пластины.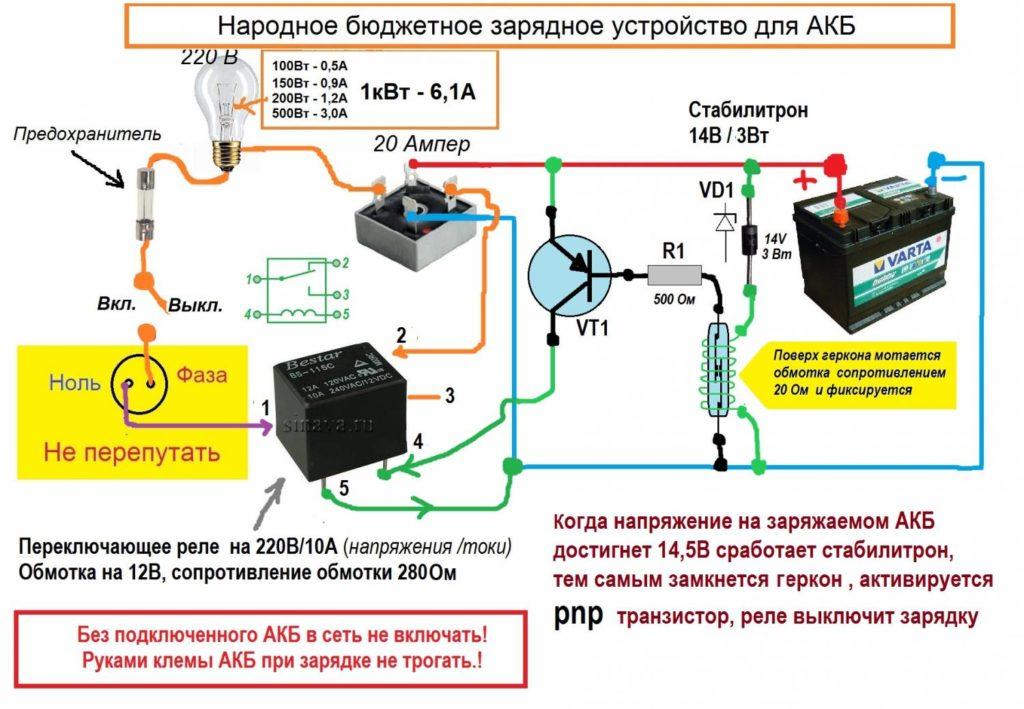 Хотя таковыми они были раньше. Современные пластины изготавливаются из свинцово-кальциевого сплава. Благодаря этому достигается низкий уровень саморазряда батареи (50% емкости теряется за 18 месяцев). Также это позволяет экономно расходовать воду (всего 1 грамм на ампер-час).
Хотя таковыми они были раньше. Современные пластины изготавливаются из свинцово-кальциевого сплава. Благодаря этому достигается низкий уровень саморазряда батареи (50% емкости теряется за 18 месяцев). Также это позволяет экономно расходовать воду (всего 1 грамм на ампер-час).
Можно встретить и гибридную конструкцию, где, кроме свинца, в положительный электрод добавляется сурьма, а в отрицательный – кальций. Правда, в таких случаях имеется повышенный расход воды. Чтобы повысить стойкость к коррозийным процессам, добавляют олово или серебро.
Электроды изготавливаются с решетчатой структурой, их покрывают слоем активной массы. Принцип работы аккумуляторной батареи в немалой степени зависит от того, какой материал используется для пластин. Мы рассматриваем свинцовые, которые просты для изучения, но ориентироваться на них всегда не рекомендуем.
Электролит
Рассматриваем все те же свинцово-кислотные батареи. В качестве электролита, в который они помещаются, чаще всего выступает серная кислота. Она обладает определённой плотностью, которая может меняться в зависимости от уровня заряда батареи. В данном случае действует принцип: чем больше, тем выше. Со временем электролит улетучивается, и емкость аккумуляторной батареи падает. На сроке службы сказываются особенности эксплуатации (соблюдение техники безопасности). В батареях электролит может быть двух типов:
Она обладает определённой плотностью, которая может меняться в зависимости от уровня заряда батареи. В данном случае действует принцип: чем больше, тем выше. Со временем электролит улетучивается, и емкость аккумуляторной батареи падает. На сроке службы сказываются особенности эксплуатации (соблюдение техники безопасности). В батареях электролит может быть двух типов:
- жидким;
- в виде пропитанного специального материала.
На данный момент наиболее распространён первый тип.
Эксплуатация аккумуляторных батарей
Использование аккумуляторов можно наблюдать практически везде. Вспомните свои мобильные телефоны или источники бесперебойного питания для компьютеров. В качестве примера можно привести и обычный фонарик (современные образцы всё чаще изготавливаются со встроенным аккумулятором и не рассчитаны на гальванические элементы). А автомобили? Системы «стоп-старт» и рекуперативного торможения работают от аккумуляторов, причем они выдвигают высокие требования к пусковому току, глубокому разряду и долговечности. Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.
Как видите, без этих источников питания сложно обойтись в современной жизни любому человеку.
Схема построения аккумуляторной батареи
Мы рассмотрели основную информацию о данных устройствах. Давайте ещё уделим внимание такому понятию, как схема аккумуляторной батареи. Ведь в рамках статьи по нему прошлись только вскользь. Аккумулятор современной схемы, согласно истории, был впервые создан французским физиком Гастоном Плантом. Площадь его творения превышала 10 квадратных метров! Современные батареи, по сути, являются просто значительно уменьшенными и немного доработанными копиями его аккумулятора. Видимым для человека элементом является только корпус. Он обеспечивает общность и целостность конструкции.
Устройство аккумулятора
Базовый принцип работы свинцово-кислотного аккумулятора (АКБ), определяемый термином «двойная сульфатация», был разработан (изобретен) более полутора веков назад в районе 1860 года и с тех пор никаких принципиальных новшеств не претерпел.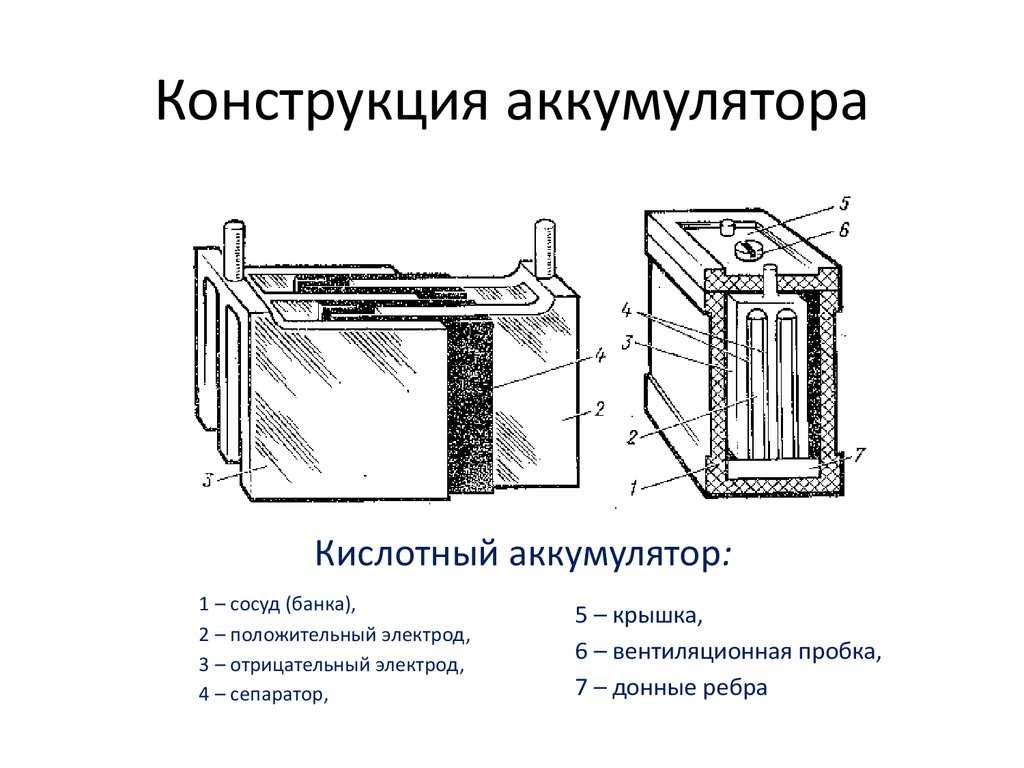 Появилось достаточное количество специализированных моделей, но устройство аккумулятора выпущенного вчера в Японии или производимого сегодня в России или в Германии, такое же, как и устройство самой первой батареи собранной «на коленке» во Франции, с неизбежными улучшениями и оптимизацией.
Появилось достаточное количество специализированных моделей, но устройство аккумулятора выпущенного вчера в Японии или производимого сегодня в России или в Германии, такое же, как и устройство самой первой батареи собранной «на коленке» во Франции, с неизбежными улучшениями и оптимизацией.
Содержание
- Назначение
- Правила подзарядки
- Устройство кислотного АКБ и принцип его работы
- Работа кислотного аккумулятора
- Как устроена щелочная батарея и принцип ее работы
- Достоинства щелочной АКБ
- Заключение
Назначение
АКБ в обычном автомобиле предназначен для работы стартера при запуске двигателя и для устойчивого снабжения заданного вольтажа электроэнергией, многочисленного электрооборудования. При этом роль автомобильного аккумулятора, как «энергетического буфера», при недостаточном поступлении энергии от генератора не менее важна. Типичный пример подобного режима – при работе двигателя на холостых оборотах во время стояния в пробке. В такие моменты весь электропакет и дополнительное сервис-оборудование запитаны только от аккумулятора. Критически важна роль кислотного аккумулятора при аварийных форс-мажорах: поломка генератора, регулятора напряжения, выпрямителя тока, при обрыве ремня генератора.
В такие моменты весь электропакет и дополнительное сервис-оборудование запитаны только от аккумулятора. Критически важна роль кислотного аккумулятора при аварийных форс-мажорах: поломка генератора, регулятора напряжения, выпрямителя тока, при обрыве ремня генератора.
Правила подзарядки
Подзарядка свинцово-кислотного автомобильного аккумулятора в штатном режиме производится от генератора. При интенсивной работе батареи требуется ее дополнительная подзарядка в стационарных условиях через специальное зарядное устройство. Особенно это актуально в зимнее время, когда возможность холодной батареи принимать заряд резко снижается, а потребление энергии на раскрутку мотора на морозе возрастает. Поэтому зарядку автомобильного АКБ необходимо проводить в тепле после его согревания естественным образом.
Важно! Ускорение согревания батареи горячей водой или феном недопустимо, так как реально разрушение пластин вследствие резкого перепада температур. При опадении наполнителя на дно банок, резко возрастает возможность саморазряда за счет замыкания пластин.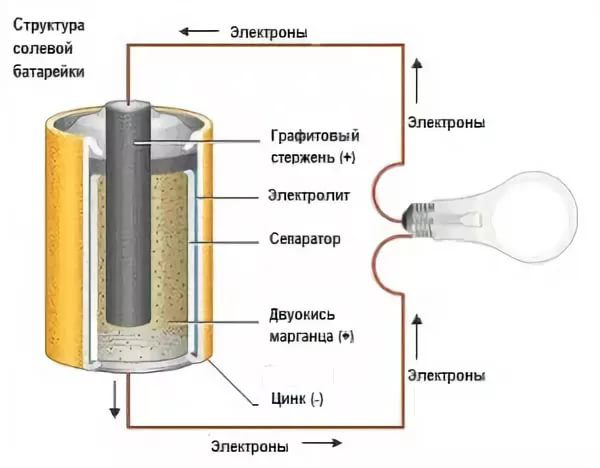
Для так называемых «кальциевых» аккумуляторов, недопущение полного или значительного разряда критически важно, потому что ресурс этого типа батарей ограничен 4-5 циклами полной разрядки, после чего аккумулятор приходит в негодность.
В современных гибридных автомобилях и в электромобилях аккумуляторная батарея имеет повышенные размеры и емкость, обеспечивая движение. Их так и называют – тяговые. В «чистых» электромобилях только аккумуляторы являются поставщиком энергии для движения и работы всего электрооборудования, отчего имеют значительные размеры и в разы большую емкость, чем батарея в «классическом» автомобиле с карбюраторным двигателем. Например: танковые, тепловозные, на подводных лодках и так далее. Хотя принцип кислотного аккумулятора во всех случаях одинаков за исключением размеров.
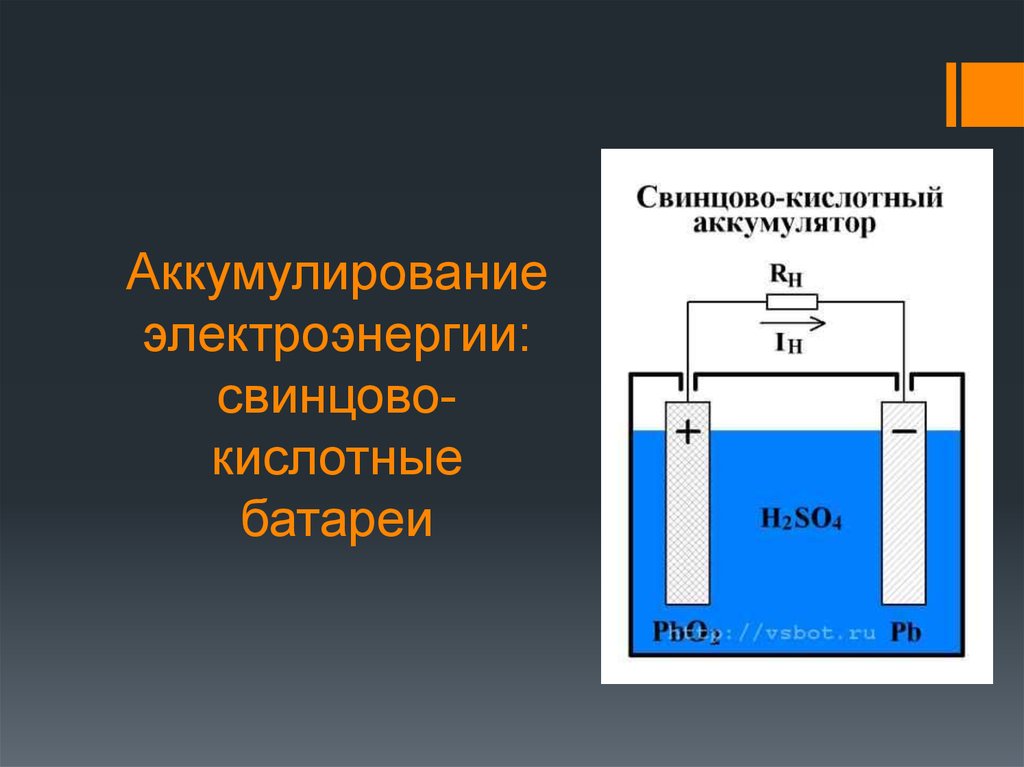
Устройство кислотного АКБ и принцип его работы
Устройство кислотной АКБ (свинцово-кислотного) различного назначения, от разных производителей отличается не принципиально и в тезисной форме выглядит следующим образом:
- пластиковый контейнер-корпус из инертного, устойчивого к агрессивной среде материала;
- в общем корпусе располагается несколько модулей-банок (как правило шесть), которые являются полноценными источниками тока и соединяются между собой тем или иным способом в зависимости от основных задач;
- в каждой банке располагаются плотные пакеты, состоящие последовательно из разделенных диэлектрическими сепараторами отрицательно и положительно заряженных пластин (свинцовый катод и анод из диоксида свинца соответственно).
 Каждая пара пластин является источником тока, их параллельное соединение кратно увеличивает выдаваемое на напряжение;
Каждая пара пластин является источником тока, их параллельное соединение кратно увеличивает выдаваемое на напряжение; - пакеты залиты раствором химически чистой серной кислоты, разбавленной до определенной плотности дистиллированной водой.
Работа кислотного аккумулятора
В процессе работы кислотного аккумулятора на катодных пластинах образуется сульфат свинца и выделяется энергия в виде электрического тока. За счет выделяемой в процессе электрохимической реакции воды плотность кислотного электролита падает, он становится менее концентрированным. При подаче напряжения на клеммы в процессе зарядки происходит обратный процесс с восстановлением свинца до металлической формы и повышается концентрация электролита.
Как устроена щелочная батарея и принцип ее работы
Устройство щелочной батареи аналогично таковому у кислотного. Но положительно и отрицательно заряженные пластины имеют другой элементный состав, а в качестве электролита используется раствор едкого кали определенной плотности.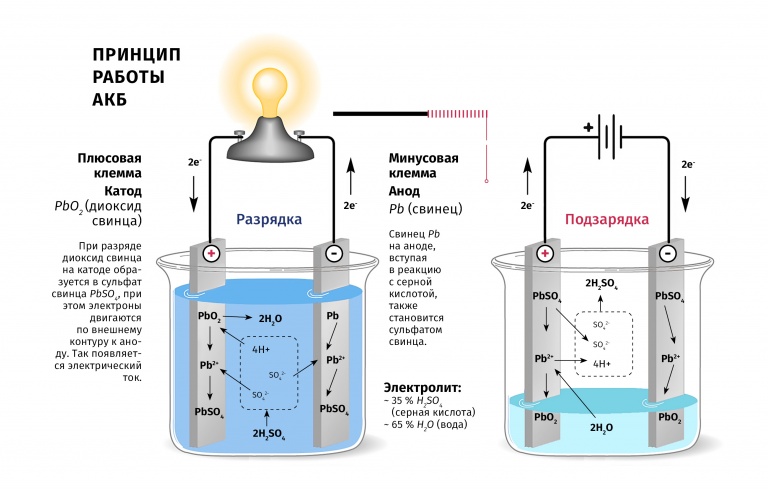 Есть и другие отличия — в самом корпусе контейнера, выводе клемм и в наличии мелкосетчатой «рубашки» вокруг каждой отдельной пластины.
Есть и другие отличия — в самом корпусе контейнера, выводе клемм и в наличии мелкосетчатой «рубашки» вокруг каждой отдельной пластины.
Отрицательные катоды традиционного щелочного аккумулятора выполнены из губчатого кадмия с примесью губчатого железа, положительные – из гидроокиси трехвалентного никеля с добавлением чешуйчатого графита, добавка которого, обеспечивает лучшую электропроводность катода. Пары пластин параллельно соединяются между собой в банках, которые тоже соединены параллельно. В процессе зарядки щелочного аккумулятора двухвалентный никель в гидрате закиси меняет валентность до значения «8» и превращается в гидрат окиси; соединения кадмия и железа восстанавливаются до металлов. При разрядке процессы противоположны.
Достоинства щелочной АКБ
К достоинствам щелочного типа относятся:
- внутреннее устройство обеспечивает повышенную устойчивость к механическим нагрузкам, в том числе к тряске и ударам;
- разрядные токи могут быть значительно выше, чем у кислотного аналога;
- в принципе отсутствует испарение/выделение вредных веществ с газами;
- легче и меньше при равных емкостях;
- имеют очень высокий ресурс и служат в 7-8 раз дольше;
- для них не является критичными перезаряд или недозаряд;
- эксплуатация их проста.

По достижении максимального возможного заряда и при продолжении подключения к зарядному устройству никаких отрицательных электрохимических процессов с элементами не происходит. Просто начинается электролиз воды на водород и кислород с ростом концентрации едкого кали и падением уровня электролита, что безопасно и легко компенсируется добавлением дистиллированной воды.
Очевидно, что имеются показатели, по которым этот тип аккумуляторов хуже кислотного:
- использование дорогостоящих материалов повышает стоимость на единицу емкости до четырех раз;
- более низкое – 1,25 В против 2 и выше В — напряжение на элементах.
Заключение
Правильная эксплуатация любого типа АКБ обеспечивает его долгую и надежную работу, что не только позволяет экономить финансы, но и гарантирует большую безопасность и комфорт при езде на автомобиле.
Как работают батареи? | Живая наука
Батарея работает, замыкая цепь внутри электрического устройства.
(Изображение предоставлено: Mrs_ya | Shutterstock)
Батарейки повсюду. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на широкое распространение в повседневной жизни людей, батареи часто остаются незамеченными. Подумайте об этом: вы действительно знаете, как работает батарея? Не могли бы вы объяснить это кому-то другому?
Вот краткое изложение научных данных об источниках энергии, питающих смартфоны, электромобили, кардиостимуляторы и многое другое. [Викторина: электрические и газовые транспортные средства]
Анатомия аккумулятора
Большинство аккумуляторов состоят из трех основных частей: электродов, электролита и сепаратора, по словам Энн Мари Састри, соучредителя и генерального директора компании Sakti3 из Мичигана. запуск аккумуляторной технологии.
В каждой батарее два электрода. Оба сделаны из проводящих материалов, но выполняют разные роли. Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разрядки.
Один электрод, известный как катод, соединяется с положительным полюсом батареи и находится там, где электрический ток покидает батарею (или электроны входят в нее) во время разряда, то есть когда батарея используется для питания чего-либо. Другой электрод, известный как анод, соединяется с отрицательным полюсом батареи и через него поступает электрический ток (или выходят электроны) из батареи во время разрядки.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы. Ионы соединяются с материалами, из которых состоят электроды, вызывая химические реакции, которые позволяют батарее генерировать электрический ток. [Взгляд изнутри на то, как работают батареи (инфографика)]
Типичные батареи питаются за счет химической реакции. [Посмотреть полную инфографику] (Изображение предоставлено Карлом Тейтом, художником по инфографике)
Последняя часть батареи, сепаратор, довольно проста.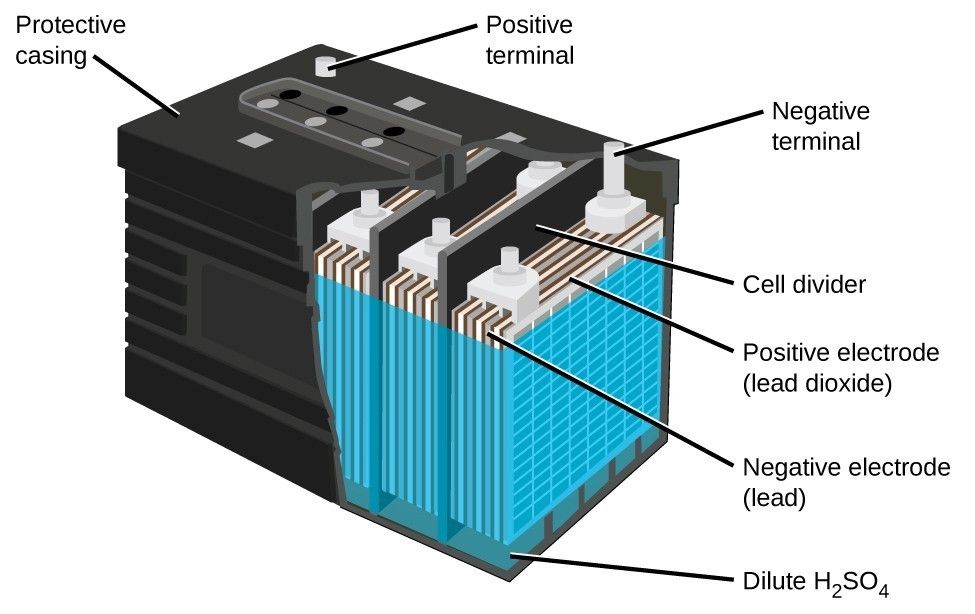 Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Роль сепаратора заключается в том, чтобы отделить анод и катод друг от друга внутри батареи. По словам Састри, без сепаратора два электрода соприкоснулись бы, что привело бы к короткому замыканию и препятствовало бы нормальной работе батареи.
Как это работает
Чтобы представить себе, как работает батарейка, представьте, что вы вставляете щелочные батарейки типа двойных АА в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь. Химическая энергия, хранящаяся в батарее, преобразуется в электрическую энергию, которая уходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но уже на противоположном конце от исходного.
Все части батареи работают вместе, чтобы фонарик загорелся. Электроды в батарее содержат атомы некоторых проводящих материалов. Например, в щелочной батарее анод обычно сделан из цинка, а диоксид марганца выступает в качестве катода.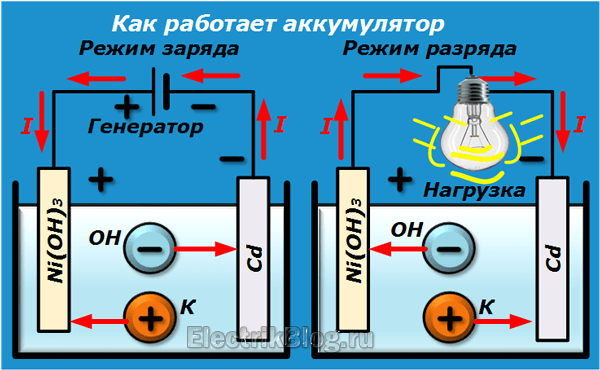 А электролит между и внутри этих электродов содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
А электролит между и внутри этих электродов содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, происходящих в электродах, известна под общим названием окислительно-восстановительные (окислительно-восстановительные) реакции. В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к высвобождению электронов из атомов электрода, сказал Састри.
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате два электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, когда расходуются электроны (которые отрицательно заряжены). Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду.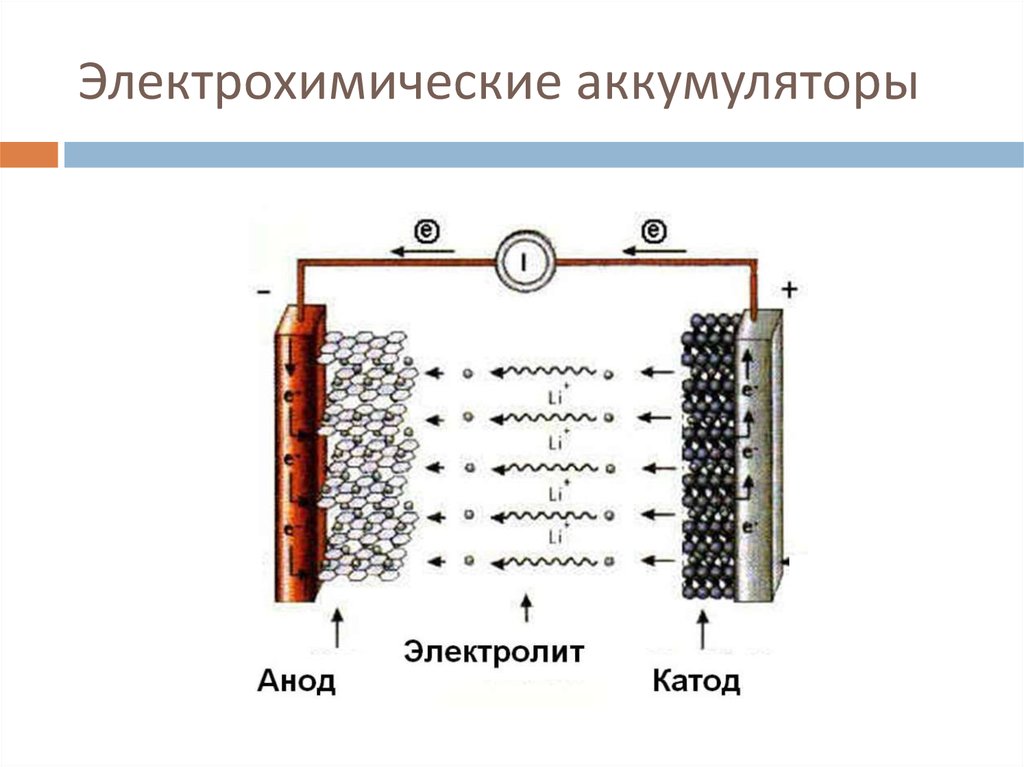 Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Однако у них нет возможности проникнуть внутрь батареи, поскольку сепаратор не позволяет им это сделать.
Когда вы щелкаете выключателем фонарика, все меняется. Теперь у электронов есть путь к катоду. Но сначала они должны пройти через основание лампы вашего фонаря. Цепь замыкается, когда электрический ток снова входит в батарею через верхнюю часть батареи на катоде.
Перезаряжаемые и неперезаряжаемые
Для первичных батарей, таких как в фонарике, реакции, питающие батарею, со временем перестанут происходить, а это означает, что электроны, обеспечивающие заряд батареи, больше не будут создавать электрический ток. Когда это происходит, батарея разряжается или «разряжается», сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставляют батарею производить энергию, необратимы, объяснил Састри. Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, можно обратить вспять, подав в батарею электрическую энергию. Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Одними из наиболее распространенных сегодня вторичных батарей являются литий-ионные (Li-ion) батареи, которые питают большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе. Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металлогидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и беспроводные электроинструменты. Свинцово-кислотные (Pb-кислотные) батареи обычно используются для питания автомобилей и других транспортных средств для запуска, освещения и зажигания.
Все эти перезаряжаемые батареи работают по одному и тому же принципу, сказал Састри: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, а анод и катод возвращаются в исходное состояние.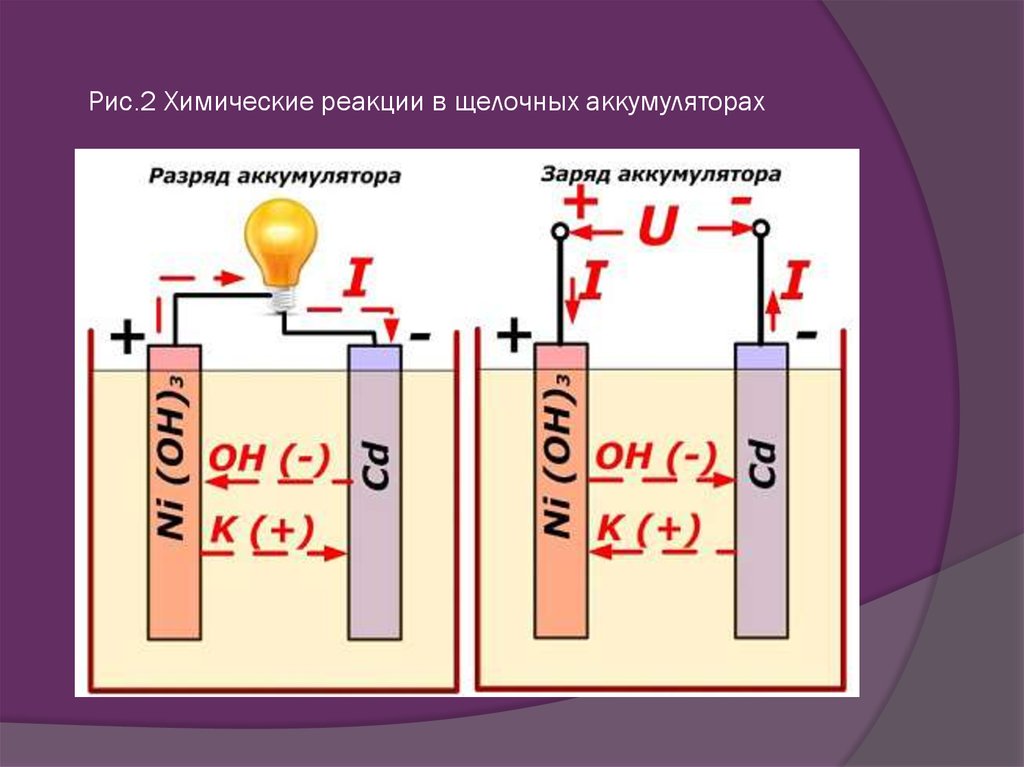 [10 ведущих прорывных технологий]
[10 ведущих прорывных технологий]
Батарейный жаргон
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при обсуждении аккумуляторов:
Напряжение : Когда речь идет о батареях, напряжение — также известное как номинальное напряжение элемента — описывает величину электрической силы или давления, при котором свободные электроны перемещаются от положительного полюса батареи к отрицательному, объяснил Састри. . В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (большая электрическая сила). Батарейки в фонарике обычно имеют напряжение 1,5 вольта. Однако, если фонарик использует две последовательно соединенные батареи, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные аккумуляторы, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольта. Но обычно в автомобильном аккумуляторе шесть таких элементов соединены последовательно, поэтому вы, вероятно, слышали, что такие батареи называются 12-вольтовыми.
Но обычно в автомобильном аккумуляторе шесть таких элементов соединены последовательно, поэтому вы, вероятно, слышали, что такие батареи называются 12-вольтовыми.
Литий-кобальт-оксидные батареи — наиболее распространенный тип литий-ионных батарей в бытовой электронике — имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер, или ампер, является мерой электрического тока или количества электронов, протекающих через цепь в течение определенного периода времени.
Емкость : Емкость или емкость элемента измеряется в ампер-часах, что представляет собой количество часов, в течение которых батарея может обеспечивать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райс. Факультет электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно подавать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и считается разряженной.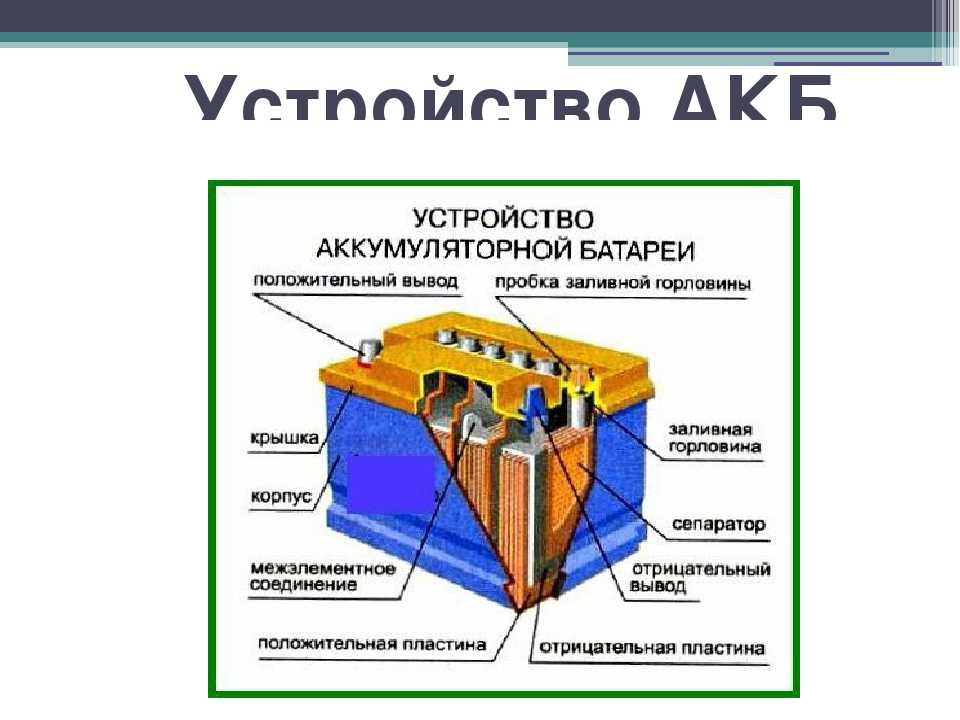
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей удельная мощность важна, потому что она говорит вам, как быстро автомобиль может разгоняться от 0 до 60 миль в час (97 км/ч). Инженеры постоянно пытаются придумать способы сделать батареи меньше, не уменьшая их плотность мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна выдать батарея, деленное на объем или массу батареи, сказал Састри. Это число соответствует вещам, которые оказывают большое влияние на пользователей, например, сколько времени вам нужно, чтобы зарядить свой мобильный телефон, или как далеко вы можете проехать на своем электромобиле, прежде чем остановиться, чтобы подключить его.
Подписывайтесь на Элизабет Палермо @ techEpalermo . Подписывайтесь на Live Science @livescience , Facebook & Google+ .
Дополнительные ресурсы
- Ассоциация стандартов IEEE: Стандарты батарей
- Агентство по охране окружающей среды: Сохранение ресурсов — Батареи
- All-Battery.com: Таблица размеров (открывается в новой вкладке)
0
Элизабет — бывший помощник редактора Live Science, а в настоящее время — директор по развитию аудитории в Торговой палате. Она получила степень бакалавра искусств в Университете Джорджа Вашингтона. Элизабет путешествовала по Америке, изучая политические системы и культуры коренных народов, а также обучая английскому языку учащихся всех возрастов.
Принцип работы литий-ионного аккумулятора — E-Lyte Innovations GmbH
Литий-ионные батареи относятся к группе батарей, которые генерируют электрическую энергию путем преобразования химической энергии посредством окислительно-восстановительных реакций на активных материалах, т. е. отрицательном (аноде) и положительном электроде (катоде), в одном или нескольких электрически соединенных гальванических элементах. Литий-ионные батареи можно разделить на первичные (неперезаряжаемые) и вторичные (перезаряжаемые) батареи, в зависимости от того, перезаряжаются ли они электрическим током.
Литий-ионные батареи можно разделить на первичные (неперезаряжаемые) и вторичные (перезаряжаемые) батареи, в зависимости от того, перезаряжаются ли они электрическим током.
В обычных литий-ионных батареях ионы Li + перемещаются между положительным электродом (обычно из слоистого оксида переходного металла) и отрицательным электродом на основе графита по принципу «кресла-качалки» (см. видео) .
Термин «разрядка» используется для обозначения процесса, при котором батарея подает электрическую энергию на внешнюю нагрузку. Электролит в этой системе содержит дополнительные ионы Li + для обеспечения быстрого переноса ионного заряда внутри элемента.
Помимо ионной проводимости, электролит выполняет другие важные функции:
Поддержка образования эффективных межфазных фаз (например, межфазная фаза твердого электролита, SEI или межфазная фаза катодного электролита, CEI), которые:
Способствуют безопасности клеток – будучи инертными по отношению к другим материалам, таким как:
- Сепаратор
- Токоприемники
- Проводящие добавки, связующие
- Корпус ячейки
Шаг 1 — Исходное состояние (состояние заряда (SOC) 0%)
При разрядке ионы Li + — находятся в материале положительного электрода. Таким образом, положительный электрод является источником ионов Li + -, необходимых для преобразования электрической энергии в химическую. Чтобы позволить Ли + -ионы мигрируют от положительного электрода к отрицательному электроду, электролит также обогащается ионами Li + -ионами.
Таким образом, положительный электрод является источником ионов Li + -, необходимых для преобразования электрической энергии в химическую. Чтобы позволить Ли + -ионы мигрируют от положительного электрода к отрицательному электроду, электролит также обогащается ионами Li + -ионами.
Шаг 2 — Формирование SEI и CEI
В самом начале первого процесса зарядки электроны мигрируют из материала положительного электрода (окисление) через внешний проводник в материал отрицательного электрода (восстановление). Для обеспечения зарядовой нейтральности Li + -ионы деинтеркалируют из материала положительного электрода в электролит и мигрируют через электролит в материал отрицательного электрода для последующего хранения. В результате этих реакций на границах раздела электролит/поверхность отрицательного электрода и электролит/положительный электрод соответственно образуются граничные фазы, так называемые SEI и CEI. Эти межфазные слои образованы нерастворимыми продуктами электрохимического разложения компонентов электролита и Li + -ионы, происходящие от положительного электрода, и обеспечивают обратимый цикл батареи. После образования SEI и CEI дальнейшие ионы Li + деинтеркалируют из материала положительного электрода в электролит и мигрируют через него к материалу отрицательного электрода для последующего включения в последний.
Эти межфазные слои образованы нерастворимыми продуктами электрохимического разложения компонентов электролита и Li + -ионы, происходящие от положительного электрода, и обеспечивают обратимый цикл батареи. После образования SEI и CEI дальнейшие ионы Li + деинтеркалируют из материала положительного электрода в электролит и мигрируют через него к материалу отрицательного электрода для последующего включения в последний.
Этап 3. Электродные реакции
После формирования SEI и CEI далее Li 9Ионы 0113 + деинтеркалируют из материала положительного электрода в электролит и мигрируют через него в материал отрицательного электрода для последующего включения в последний.
Positive electrode:
Li M O 2 → Li (1- x ) M O 2 + x ·e – + x ·Li +
Отрицательный электрод:
C 6 + x ·e – + x ·Li + → Li x C 6
Overall cell reaction:
C 6 + Li M O 2 → Li x C 6 + Li (1- x ) MO 2
8
Шаг 4 — Изменение цвета при интеркаляции/деинтеркаляции в графит
В зависимости от количества ионов Li + , встроенных в отрицательный электрод (в зависимости от состояния заряда, SOC), он меняет цвет с черного на красный (ранний SOC) на золотой (100% SOC).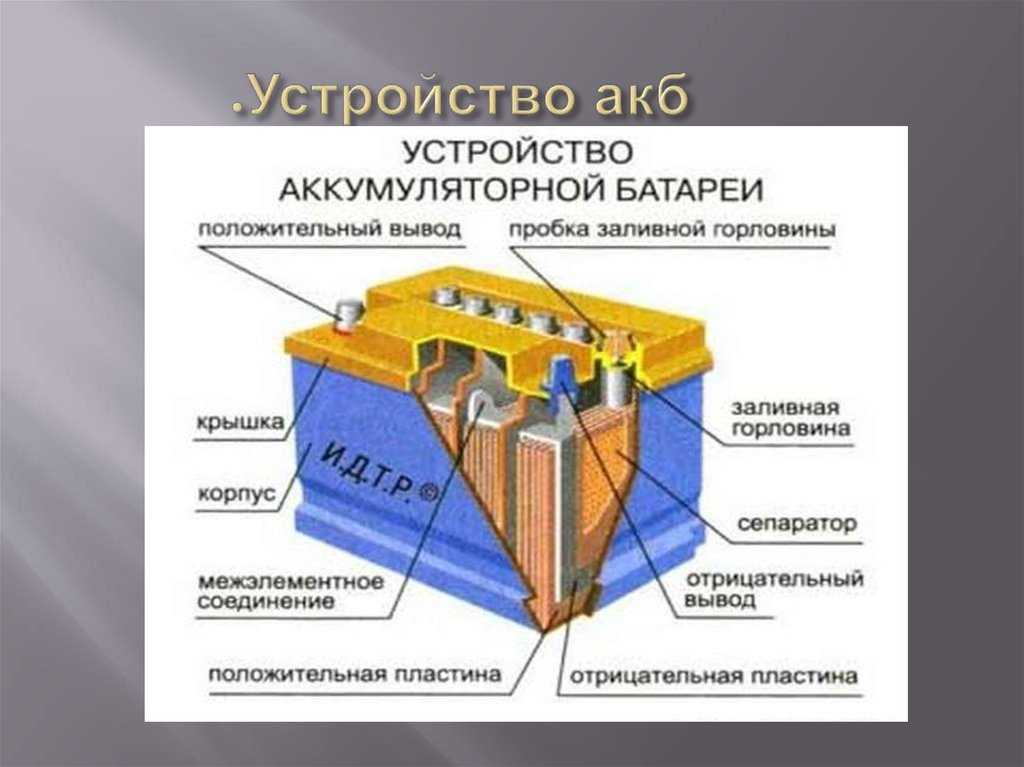
Шаг 5 — Выписка
При разряде идут обратные реакции. Электродные реакции:
Положительный электрод = «катод» (восстановление)
LI (1- x ) M O 2 + x · E — + x · LI + → LI M 6 · LI + → LI M 6 oly 9010. 6 2 90766. 90766 2 9076. 90766 2 . 90766 2 . 9076. 90766 2 . Электрод = «анод» (окисление)
LI x C 6 → C 6 + x · E — + x · LIT + + — + x · li
Шаг 6 — Принцип кресла-качалки
После разряда (SOC 0%) ионы Li + восстанавливаются в материале положительного электрода, из которого они были первоначально получены. Возвратно-поступательное движение Li + -ионов напоминает движение кресла-качалки, поэтому этот принцип получил название «принцип кресла-качалки».
Возвратно-поступательное движение Li + -ионов напоминает движение кресла-качалки, поэтому этот принцип получил название «принцип кресла-качалки».
Особенно первый цикл (зарядка и разрядка) связан с необратимой потерей ионов Li + — в SEI и CEI, а также в материале отрицательного электрода. В результате меньше Li + -ионы теперь могут накапливаться в отрицательном электроде в следующем цикле заряда, что приводит к снижению емкости аккумулятора.
В литий-ионном аккумуляторе происходят различные процессы старения, которые снижают производительность аккумулятора в течение периода использования и сильно зависят от химического состава элемента и предполагаемого использования аккумулятора. В частности, правильный выбор электролита оказывает огромное влияние на эти механизмы старения и еще раз подчеркивает важность электролитов, изготовленных по индивидуальному заказу.
Для оптимизации литий-ионных аккумуляторов в отношении удельной энергии и плотности энергии, срока службы и безопасности было предпринято много усилий для дальнейшего расширения возможностей применения ЛИА.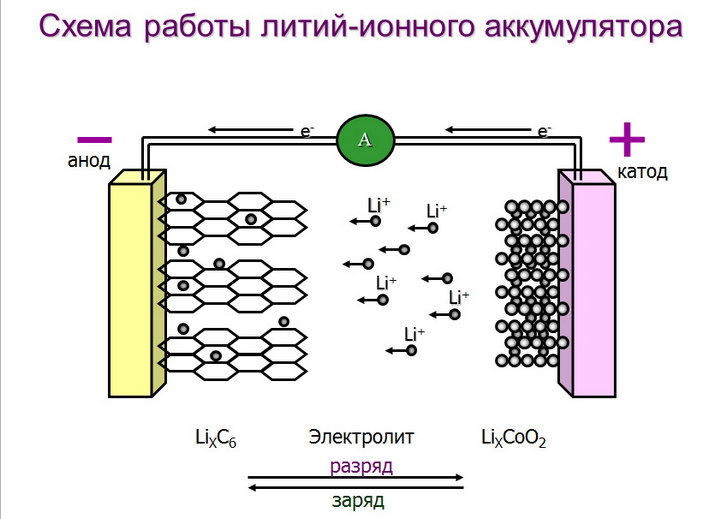 В частности, растущие потребности в литий-ионных батареях с высокой удельной энергией и плотностью энергии, особенно для автомобильных приложений, стимулируют исследовательские усилия во всем мире. Плотность энергии и удельная энергия аккумуляторов по определению — это количество энергии, запасенной в данной системе на единицу объема и на единицу массы соответственно. Произведение удельной емкости на среднее напряжение разряда дает удельную энергию, и это соотношение находит выражение в уравнении 1:
В частности, растущие потребности в литий-ионных батареях с высокой удельной энергией и плотностью энергии, особенно для автомобильных приложений, стимулируют исследовательские усилия во всем мире. Плотность энергии и удельная энергия аккумуляторов по определению — это количество энергии, запасенной в данной системе на единицу объема и на единицу массы соответственно. Произведение удельной емкости на среднее напряжение разряда дает удельную энергию, и это соотношение находит выражение в уравнении 1:
E = C · U (1)
Согласно уравнению 1 кажется разумным, что большая часть текущих исследований сосредоточена на новых материалах положительных электродов с более высокими рабочими напряжениями (подход с высоким напряжением) и/или повышенной удельной емкостью (высокопроизводительный подход). Материалы высоковольтных катодов сильно ограничены узким окном электрохимической стабильности современных электролитов на основе карбонатов (≈1,0–4,4 В против Li/Li + ) и усилить конструкцию искростабильных электролитов или подходящих добавок к электролиту, позволяющих создавать высоковольтные литий-ионные батареи.
 Задача такой емкости – сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения.
Задача такой емкости – сообщать о количестве энергии, что отдаётся во время разряда до достижения минимального допустимого напряжения. Каждая пара пластин является источником тока, их параллельное соединение кратно увеличивает выдаваемое на напряжение;
Каждая пара пластин является источником тока, их параллельное соединение кратно увеличивает выдаваемое на напряжение;