Содержание
Принцип работы и устройство автомобильного катализатора
Требования к экологической чистоте транспорта становятся все жестче, поэтому инженеры автопроизводителей работают над улучшением устройств, отвечающих за очистку выхлопных газов. Одним из них стал катализатор, устройство и принцип работы которого будет рассматриваться далее. Это ответ на все рассуждения по поводу того, что можно оптимизировать качество моторного масла, топлива, рассчитывать оптимальную смесь, при которой происходит лучшее сгорание, но для этих улучшений в какой-то момент приходит предел.
Устройство катализатора
Особенности конструкции
Принцип работы
Классификация
Срок службы катализатора
Удалить катализатор: можно или нет
Самостоятельная диагностика работы катализатора
Ужесточение требований к составу выхлопных газов, образующихся при полноценной работе двигателя внутреннего сгорания, приводит к необходимости использовать более прогрессивные решения для очистки. В состав современной выхлопной системы обязательно входят элементы системы дополнительной очистки: сажевый фильтр, нейтрализатор, система дожига топлива. Их задача состоит в минимизации вредных соединений, которые выбрасываются ТС в атмосферу во время движения.
В состав современной выхлопной системы обязательно входят элементы системы дополнительной очистки: сажевый фильтр, нейтрализатор, система дожига топлива. Их задача состоит в минимизации вредных соединений, которые выбрасываются ТС в атмосферу во время движения.
Катализатор представляет собой компонент, необходимый для нейтрализации вредных соединений, являющихся составными частями выхлопов. При сгорании топлива формируются углеводороды, окрашивающие выходящие газы в темный цвет, оксидов азота и углерода. Эти соединения и вызывают у экологов негативные реакции.
Работа нейтрализатора, изначально присутствующего в выхлопной системе, направлена на окислительно-восстановительные химические реакции, приводящие к образованию безвредных веществ: воды, углекислого газа и азота. Это треступенчатые нейтрализаторы, которые и используются в большинстве автомобилей последних моделей. Принцип работы автомобильного катализатора обеспечивает превращение опасных для экологии газов в безопасные соединения, выходящие в атмосферу.
Работа нейтрализатора не требует каких-то вспомогательных источников энергии, так как активное покрытие обеспечивает протекание любых реакций. Рабочая температура элемента достаточно высокая, поэтому он находится за выпускным коллектором, но не слишком близко к мотору, чтобы не перегреваться. Такое расположение обеспечивает выход на рабочий режим за счет разогрева раскаленными выхлопными газами.
Принцип работы катализатора обеспечивает его полноценное функционирование после полного прогревания. Контролировать его работу должны лямбда-зонды – датчики кислорода, установленные перед входом в катализатор и после выхода из него. Для электронного блока управления важной является информация по количеству остаточного кислорода в выхлопе, по которому делаются выводы о функционировании мотора. Если требуется коррекция, то ЭБУ передает сигнал на увеличение или уменьшение воздушной и топливной подачи в систему камер сгорания.
Особенности конструкции
Если принцип работы катализатора выхлопных газов понятен, то можно сказать несколько слов об его устройстве. Нейтрализатор состоит из нескольких ключевых компонентов:
Нейтрализатор состоит из нескольких ключевых компонентов:
- Сразу за выпускным коллектором размещен цельный стальной корпус, внутри которого есть термоизолирующий слой, защищающий основной компонент.
- Нейтрализатор имеет наполнитель в виде сотовой структуры, покрытой внутри активным слоем. В зависимости от производителя устройства в качестве каталитического вещества может использоваться родий, платина, палладий, платиново-иридиевый сплав. Сотовая структура обеспечивает повышение площади контакта газов с активным вещество, поэтому химические реакции проходят более интенсивно.
- Наполнитель изготовлен из металла или керамики. Выбор материала зависит от конструкции и конечной стоимости оборудования.
Принцип работы
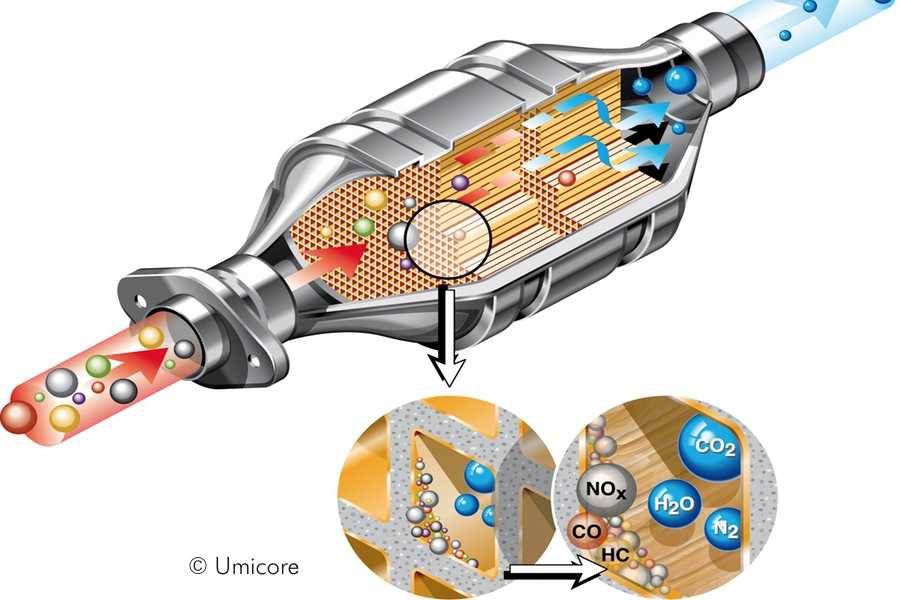
Принцип работы катализатора в автомобиле достаточно прост и базируется на определенной последовательности химических реакций:
- Внутренняя поверхность сот покрыта драгоценными металлами, которые отвечают за активацию процессов окисления.

- Оксид азота в результате реакции разлагается на атомы азота и кислорода. Азот объединяется в молекулы, образуя устойчивый азот. Кислород соединяется с угарным газом до образования углекислого газа.
- Катализатор захватывает из выхлопных газов остаточный кислород, расщепляет углеводороды, давая на выходе такие соединения, как углекислый газ и вода.
- Остаточный кислород на выходе из катализатора фиксируется лямбда-зондом, чтобы передать сведения о работе устройства штатному бортовому компьютеру.
Исправное устройство в оптимальных условиях не накапливает ничего внутри себя: все вещества, которые поступают в нейтрализатор, покидают его сотовую структуру. Но добиться этого практически невозможно, поэтому со временем происходит деградация каталитического нейтрализатора, что не дает ему полноценно справляться с задачей.
Классификация
Катализаторы можно разделить на категории по функциональности: на двух- и трехкомпонентные. Первый тип работает только с обезвреживанием угарного газа с углеводородами. Такие модели считаются устаревшими, поэтому не устанавливаются на автомобилях новых версий. Трехкомпонентные обеспечивают нейтрализацию оксида азота. Этот вид теперь устанавливается на всех современных автомобилях.
Первый тип работает только с обезвреживанием угарного газа с углеводородами. Такие модели считаются устаревшими, поэтому не устанавливаются на автомобилях новых версий. Трехкомпонентные обеспечивают нейтрализацию оксида азота. Этот вид теперь устанавливается на всех современных автомобилях.
Если говорить о материале изготовления, то принято выделять керамические, металлические и спортивные:
- Керамические считаются самыми дешевыми, но это и наиболее хрупкие катализаторы. При ударе по корпусу происходит разрушение сердцевины. Устройства страдают от перепадов температур, сбоев в системе зажигания авто. Катализатор может постепенно разрушаться, что приводит к образованию большого количества мелкой пыли, которая проникает сквозь выпускной коллектор в мотор, что приводит к поломкам. В результате всех этих неполадок может потребоваться капитальный ремонт.
- Металлические – это дорогие, но надежные устройства, изготовленные из металлической структуры в виде сот. Она отличается упругостью и устойчивостью к механическим и температурным воздействиям.
 Металл не способен образовывать мелкие частицы, поэтому для двигателя он не представляет опасности.
Металл не способен образовывать мелкие частицы, поэтому для двигателя он не представляет опасности. - Спортивные отличаются повышенной пропускной способностью, поэтому мотор становится мощнее на несколько процентов. Спортивные монтируются в прямоточные системы выхлопных газов. Их считают наиболее надежными, хоть они и самые дорогостоящие.
Срок службы катализатора
Для катализатора средний ресурс составляет 100 тысяч километров пробега, но в условиях правильной эксплуатации он способен исправно отработать до 200 тысяч. Ранний износ может произойти из-за низкого качества топлива (топливно-воздушной смеси) и проблем с мотором.
Если топливная смесь обедненная, то случается перегрев нейтрализатора, если слишком богатая, то это приводит к засорению пористого блока остатками несгоревшего топлива, из-за чего не протекают необходимые химические реакции. Это вызывает проблемы в работе катализатора с его ускоренным выходом из строя.
Механические повреждения тоже часто приводят к возникновению неисправностей. Удары и различные механические воздействия приводят к возникновению трещин. Это становится причиной стремительного разрушения блоков.
Удары и различные механические воздействия приводят к возникновению трещин. Это становится причиной стремительного разрушения блоков.
Если возникает любая неисправность, каталитический нейтрализатор начинает хуже работать, что можно понять по показаниям, поступающим в ЭБУ от лямбда-зонда, установленного на выходе из нейтрализатора. Сообщение о неисправности может высвечиваться на приборной панели в виде ошибки «Check Engine». Помимо этого, о выходе из строя свидетельствует ухудшение динамики, увеличение топливного расхода и дребезжание при движении.
В такой ситуации требуется его замена на новый. При этом можно установить новый оригинальный компонент либо воспользоваться универсальным. Восстановление или чистка не возможны, а так как новый компонент обычно стоит довольно дорого, многие автовладельцы предпочитают удалить его.
Удалить катализатор: можно или нет
Так как повлиять на принцип работы датчика катализатора невозможно, и он будет выдавать ошибку, если компонент вышел из строя, то многие автовладельцы предпочитают использовать альтернативные довольно радикальные подходы.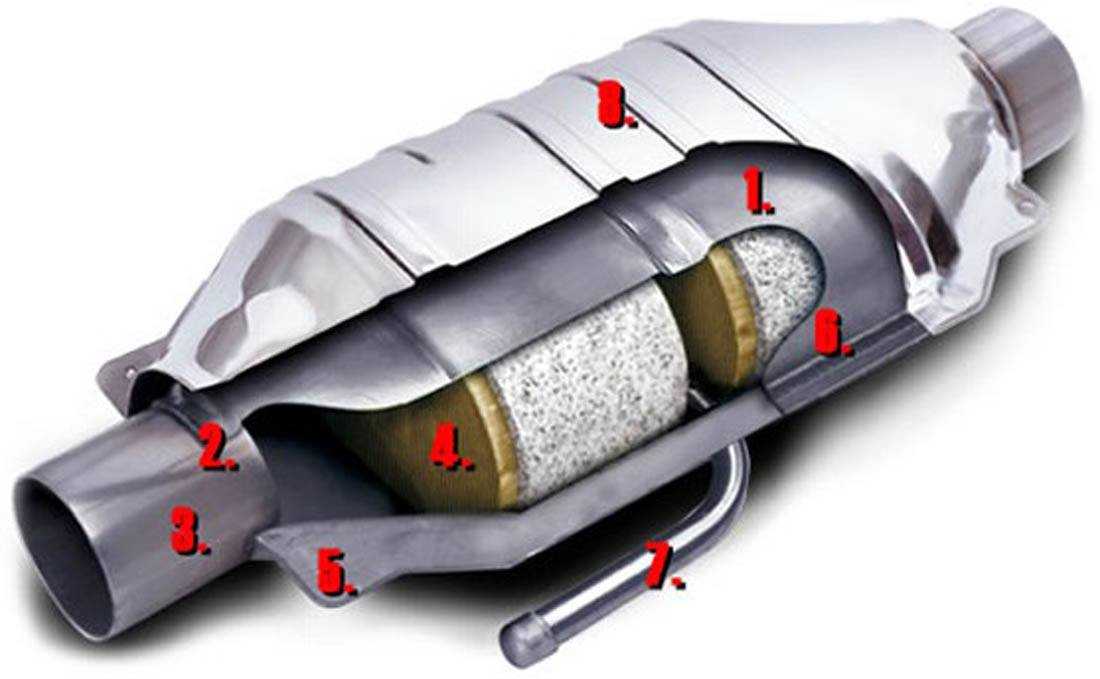 Чаще всего просто удаляют катализатор, а на его место устанавливают пламегаситель, который выравнивает поток выхлопных газов. Его рекомендуется использовать для устранения неприятных шумов, сопровождающих движение транспорта, у которого отсутствует катализатор.
Чаще всего просто удаляют катализатор, а на его место устанавливают пламегаситель, который выравнивает поток выхлопных газов. Его рекомендуется использовать для устранения неприятных шумов, сопровождающих движение транспорта, у которого отсутствует катализатор.
Если было решено удалить катализатор, то рекомендуется его полностью снять, а не прибегать к рекомендации автомобилистов просто пробить отверстие в нем. Такая процедура способна слегка улучшить ситуацию на некоторое время.
В машине, которая соответствует экологическому стандарту Евро-3, требуется не только удалить катализатор, но и выполнить перепрошивку ЭБУ. Обновление выполняется до версии, в которой каталитический нейтрализатор отсутствует.
Дополнительно можно установить эмулятор сигнала от кислородного датчика, чтобы не потребовалось перепрошивать ЭБУ полностью.
Самое лучшее решение при поломке каталитического нейтрализатора – это его замена на оригинальный компонент в рамках специализированного сервиса, где работают профессиональные мастера с достаточным опытом. Это обеспечивает исключение вмешательства в конструкцию автомобиля, поэтому сохранится соответствие его экологического класса стандарту, прописанному производителем.
Это обеспечивает исключение вмешательства в конструкцию автомобиля, поэтому сохранится соответствие его экологического класса стандарту, прописанному производителем.
Самостоятельная диагностика работы катализатора
Если машина стала ездить хуже, а на приборной панели загорелся «чек», то можно отправиться в сервисный центр, где после тщательной диагностики станет понятно, что произошло. Однако можно самостоятельно выполнить элементарную диагностику функционирования катализатора:
- Оценить оттенок выхлопа: если он черный, то это явный признак того, что нейтрализатор не работает, поэтому через него и проходят все вредные вещества и газу наружу.
- Оценить давление газов, выходящих наружу: если приложить ладонь к отверстию выхлопной трубы, то напор должен быть высоким. Если он низкий, то это свидетельствует о необходимости замены катализатора.
- После длительной поездки заглянуть под машину: если корпус катализатора раскален, то можно говорить о снижении его пропускной способности.

- В сервисе можно проверить давление выхлопа и сравнить его с показателями эталонных данных. Для определения давления манометр размещается там, где обычно установлен лямбда-зонд.
- Визуально можно оценить демонтированный нейтрализатор выхлопа на предмет оплавления, засорения или выгорания.
Заменить катализатор требуется после того, как точно установлено, что проблемы в работе автомобиля возникли из-за оплавленных или забитых сот. Но рекомендуется отыскать причину, по которой случилось засорение нейтрализатора, так как после установке нового элемента он тоже может пострадать от тех же неполадок. Поэтому в современных авто все системы связаны очень сильно, для чего используется большое количество датчиков.
Принцип работы катализатора в автомобиле
Выпускная система
На чтение 3 мин. Просмотров 1.4k.
Большинство автолюбителей даже не имеют представление о том, что такое автомобильный катализатор и в чем заключается принцип его работы. Именно поэтому сегодня мы попытаемся рассказать что это такое катализатор автомобильный.
Именно поэтому сегодня мы попытаемся рассказать что это такое катализатор автомобильный.
Машины являются одним из самых крупных источников загрязнений атмосферы, так как они выбрасывают в атмосферу около 15 000 химических соединений, к которым относится газ и пыль. Компании по производству автомобилей постоянно стараются уменьшить количество вредных выбросов, именно это и привело к созданию автомобильного каталитического нейтрализатора системы выхлопа или как его еще называют катализатор.
Катализатор входит в состав выхлопной системы автомобиля и предназначается для понижения уровня выбросов вредоносных веществ вместе с продуктами горения.
Катализатор автомобильный
В представленной статье мы более подробно поговорим о катализаторе, а именно обсудим такие вопросы:
- Что такое автомобильный катализатор?
- Конструкция автомобильного катализатора;
- В чем заключается принцип работы?
- Распространенные поломки каталитического нейтрализатора, при которых необходима его полная замена;
- Признаки неисправности, указывающие на то, что необходима замена;
- Как правильно проводится замена каталитического нейтрализатора выхлопной системы?
Большинство автолюбителей даже не имеют представления о том, что такое автомобильный катализатор и в чем заключается принцип его работы. Именно поэтому сегодня мы попытаемся рассказать основную информацию о каталитическом нейтрализаторе. Итак, автомобильный нейтрализатор это элемент выхлопной системы транспортного средства, снижающий температуру выхлопных газов, очищающий выхлопные газы и обеспечивающий догорание топливной смеси.
Именно поэтому сегодня мы попытаемся рассказать основную информацию о каталитическом нейтрализаторе. Итак, автомобильный нейтрализатор это элемент выхлопной системы транспортного средства, снижающий температуру выхлопных газов, очищающий выхлопные газы и обеспечивающий догорание топливной смеси.
Каталитический нейтрализатор используется на бензиновых и дизельных двигателях автомобиля. Представленное устройство чаще всего располагается за коллектором выпускной системы или же перед глушителями.
Схема катализатора автомобильного
Основными элементами катализатора являются: теплоизоляция, корпус и блок-носитель. На сегодняшний момент существует несколько видов нейтрализаторов, которые соответствуют разному содержанию выхлопных газов в автомобильном двигателе.
К основным типам автомобильного катализатора выхлопной системы относятся: восстановительный, окислительный и окислительно-восстановительный.
Для правильной замены каталитического нейтрализатора должны соблюдаться некие условия, для соблюдения этих условий применяется лямбда-зонд. Благодаря данному устройству посылается обновленная информация и регулируется состав топливной смеси.
Благодаря данному устройству посылается обновленная информация и регулируется состав топливной смеси.
Признаки неисправности, указывающие на то, что необходима замена
При нормальном функционировании катализатор ломается только после полного сгорания каталитического слоя. Такое формулирование даже не совсем правильно, так как он не ломается, а просто из-за уменьшения каталитического слоя он не может полностью сжигать выхлопные газы. То есть эффективность работы уменьшается, а токсичность продуктов горения повышается. Автомобильный катализатор достаточно редко выходит из строя, но все же каждый автолюбитель должен знать, как поступать в таком случае. Поэтому давайте рассмотрим, как проводится самостоятельная замена каталитического нейтрализатора.
Для начала давайте рассмотрим основные признаки неисправности каталитического нейтрализатора выхлопной системы:
- Снизилась мощность автомобиля, это свидетельствует о том, что нейтрализатор забит.

- Во время передвижения транспортного средства на холостых оборотах двигателя заметно плаванье стрелочки тахометра.
- И выхлопной трубки чувствуется запах аммиака.
Итак, как же правильно проводится замена катализатора?
- Открутите болтики, закрепляющие устройство на дополнительном глушителе;
- Снимите болтики вместе с шайбой;
- Открутите болтики, которые закрепляют устройство на приемной трубке;
- Достаньте болтики вместе с пружинными шайбами;
- Достаньте устройство под днищем автомобиля;
- ПРоведите замену и соберите все в обратном порядке.
Как видите, замена катализатора системы выхлопа довольно проста и с ней сможет справиться даже не очень опытный автолюбитель. Обратите внимание на то, что в момент функционирования он может нагреваться до температуры около 600 градусов. Поэтому прежде чем перейти к замене катализатора дождитесь полного его охлаждения.
3.
 1: Общие принципы катализа
1: Общие принципы катализа
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 20281
Как видно из уравнения Аррениуса, величина энергии активации \(E_a\) определяет значение константы скорости \(k\) при данной температуре и, таким образом, общую скорость реакции. Катализаторы позволяют снизить \(E_a\) и увеличить скорость реакции. Катализаторы определяются как вещества, которые участвуют в химической реакции, но не изменяются и не расходуются. Вместо этого они обеспечивают новый механизм протекания реакции, который имеет более низкую энергию активации, чем реакция без катализатора. Гомогенный катализ относится к реакциям, в которых катализатор находится в растворе по крайней мере с одним из реагентов, тогда как гетерогенный катализ относится к реакциям, в которых катализатор присутствует в другой фазе, обычно в виде твердого вещества, чем реагенты. На рисунке \(\PageIndex{1}\) показано сравнение энергетических профилей реакции в отсутствие и в присутствии катализатора.
На рисунке \(\PageIndex{1}\) показано сравнение энергетических профилей реакции в отсутствие и в присутствии катализатора.
Рисунок \(\PageIndex{1}\): Сравнение энергетических профилей с катализатором и без него.
Рассмотрим некатализируемую элементарную реакцию
\[\text{A} \overset{k}{\longrightarrow} \text{P}\]
, которая протекает со скоростью \(k\) при определенной температуре. Скорость реакции может быть выражена как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] \label{Eq1}\ ]
В присутствии катализатора \(\text{C}\) мы можем записать реакцию как
\[\text{A} + \text{C} \overset{k_\text{cat}} {\longrightarrow} \text{P} + \text{C}\]
и скорость реакции как
\[\dfrac{d \left[ \text{A} \right]}{dt} = -k \left[ \text{A} \right] — k_\text{cat } \left[ \text{A} \right] \left[ \text{C} \right] \label{Eq2}\]
где первый член представляет некатализируемую реакцию, а второй член представляет каталитическую реакцию. — &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
— &\overset{k_3}{\underset{k_{-3}}{\rightleftharpoons}} \text{A}H + H_2 O \end{align}\ ] 9+ \right]}{\left[ \text{A} H \right]} \label{Eq9}\]
В этом случае реакция катализируется ионами водорода.
Ферментный катализ
Чтобы жить, расти и размножаться, микроорганизмы претерпевают ряд химических изменений. Они изменяют питательные вещества, чтобы они могли попасть в клетку, и они меняют их, как только они входят, чтобы синтезировать части клетки и получать энергию.
Метаболизм относится ко всем организованным химическим реакциям в клетке. Реакции, в которых происходит расщепление химических соединений, называются 9.0092 катаболические реакции , а реакции синтеза химических соединений называются анаболическими реакциями . Все эти реакции находятся под контролем ферментов.
Ферменты представляют собой вещества, присутствующие в клетке в небольших количествах и функционирующие для ускорения или катализа химических реакций . На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратный комплекс (рис. 1).
На поверхности фермента обычно имеется небольшая щель, которая функционирует как активный центр или каталитический центр, с которым могут связываться один или два специфических субстрата. (Все, с чем обычно соединяется фермент, называется субстрат .) Связывание субстрата с ферментом приводит к тому, что гибкий фермент слегка меняет свою форму в результате процесса, называемого индуцированной подгонкой , с образованием временного промежуточного продукта, называемого фермент-субстратный комплекс (рис. 1).
Рисунок \(\PageIndex{2}\) : Ферменты – это вещества, присутствующие в клетке в небольших количествах, которые ускоряют или катализируют химические реакции. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом (Рисунок \(\PageIndex{3}\)). Подобно рассмотренным выше гомогенным катализаторам, ферменты снижают энергию активации за счет образования комплекса фермент-субстрат, что позволяет образовываться и высвобождаться продуктам ферментативной реакции (рис. \(\PageIndex{2}\)).
Подобно рассмотренным выше гомогенным катализаторам, ферменты снижают энергию активации за счет образования комплекса фермент-субстрат, что позволяет образовываться и высвобождаться продуктам ферментативной реакции (рис. \(\PageIndex{2}\)).
Рисунок \(\PageIndex{3}\) : Фермент ускоряет химическую реакцию, снижая свою энергию активации, энергию, которая должна быть предоставлена для того, чтобы молекулы реагировали друг с другом.
Реакции фермент-субстрат
Ферменты представляют собой вещества, присутствующие в клетке в небольших количествах, которые ускоряют или катализируют химические реакции. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Ферменты снижают энергию активации, образуя фермент-субстратный комплекс.
Многим ферментам требуется небелковый кофактор , чтобы помочь им в их реакции. В этом случае белковая часть фермента, называемая апофермент объединяется с кофактором с образованием цельного фермента или галофермента (рис. \(\PageIndex{4}\)). Некоторыми кофакторами являются ионы, такие как Ca ++, Mg ++ и K+; другие кофакторы представляют собой органические молекулы, называемые коферментами , которые служат переносчиками химических групп или электронов. НАД + , НАДФ + , ФАД и кофермент А (КоА) являются примерами коферментов.
\(\PageIndex{4}\)). Некоторыми кофакторами являются ионы, такие как Ca ++, Mg ++ и K+; другие кофакторы представляют собой органические молекулы, называемые коферментами , которые служат переносчиками химических групп или электронов. НАД + , НАДФ + , ФАД и кофермент А (КоА) являются примерами коферментов.
Рисунок \(\PageIndex{4}\) : Апофермент и кофактор объединяются, образуя галофермент. Если кофактор представляет собой органическую молекулу, он называется коферментом.
Ферменты обычно представляют собой глобулярные белки. (Некоторые молекулы РНК, называемые рибозимами, также могут быть ферментами. Обычно они находятся в ядерной области клеток и катализируют расщепление молекул РНК). Ферменты — это катализаторы, которые расщепляют или синтезируют более сложные химические соединения. Они позволяют химическим реакциям происходить достаточно быстро, чтобы поддерживать жизнь. Ферменты ускоряют скорость химических реакций, потому что они снижают энергию активации, энергию, которая должна быть выделена для того, чтобы молекулы реагировали друг с другом. Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны в отношении своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Все, с чем обычно связывается фермент, называется субстратом. Ферменты очень эффективны: обычно ферменты способны катализировать от 1 до 10 000 молекул субстрата в секунду. Это означает, что ферменты должны присутствовать в клетке только в небольших количествах. Они не изменяются во время своей реакции и очень специфичны в отношении своего субстрата, причем обычно для каждой конкретной химической реакции предназначен один конкретный фермент.
Факторы, влияющие на скорость ферментативных реакций
На активность фермента влияет ряд факторов, включая:
- Концентрация фермента скорость реакции.
- Концентрация субстрата : При постоянной концентрации фермента и более низких концентрациях субстрата концентрация субстрата является ограничивающим фактором. С увеличением концентрации субстрата скорость ферментативной реакции увеличивается. Однако при очень высоких концентрациях субстрата ферменты насыщаются субстратом, и более высокая концентрация субстрата не увеличивает скорость реакции.

- Ингибиторы: Ингибиторы ингибируют активность фермента и снижают скорость реакции. Ингибиторы ферментов будут связываться с активными центрами ферментов и могут изменять химический состав активного центра, что может препятствовать проникновению субстрата.
- Температура : Каждый фермент имеет оптимальную температуру, при которой он работает лучше всего. Более высокая температура обычно приводит к увеличению активности фермента (кинетика Аррениуса). По мере повышения температуры молекулярное движение увеличивается, что приводит к большему количеству молекулярных столкновений. Однако, если температура поднимается выше определенной точки, тепло денатурирует фермент, заставляя его терять свою трехмерную функциональную форму из-за денатурации его водородных связей. Холодная температура, с другой стороны, замедляет активность ферментов за счет уменьшения молекулярного движения.
- pH : Каждый фермент имеет оптимальный pH, который помогает поддерживать его трехмерную форму.
 Изменения pH могут денатурировать ферменты, изменяя заряд фермента. Это изменяет ионные связи фермента, которые способствуют его функциональной форме.
Изменения pH могут денатурировать ферменты, изменяя заряд фермента. Это изменяет ионные связи фермента, которые способствуют его функциональной форме. - Концентрация соли : Каждый фермент имеет оптимальную концентрацию соли. Изменения концентрации соли также могут денатурировать ферменты.
Применение ферментов
Ферменты необходимы для поддержания гомеостаза, поскольку любой сбой фермента может привести к заболеванию. Поэтому фармацевтические компании изучают ферменты для управления и синтеза новых лекарств. Помимо медицинского применения, ферменты важны в промышленности, поскольку ферменты помогают расщеплять целлюлозу, отходы и т. д. Ферменты необходимы в процессе производства новых продуктов во многих отраслях, таких как фармацевтика, пищевая, бумажная, винодельческая и т. д.
Ссылки
- «Фермент, глава 4». Авторское право IHW, октябрь 2005 г. Интернет. 5 марта 2011 г. biologymad.com/resources/Ch%2…0-20enzyme.
 pdf
pdf - Чанг, Рэймонд. Физическая химия для биологических наук. Саусалито, Калифорния: Университетские научные книги, 2005. Страницы 363-384.
Авторы и ссылки
Марк Такерман (Нью-Йоркский университет)
Доктор Гэри Кайзер (СООБЩЕСТВЕННЫЙ КОЛЛЕДЖ ОКРУГА БАЛТИМОР, КАМПУС КЭТОНСВИЛЬ)
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Показать страницу TOC
- № на стр.
- Метки

Основы катализа. Введение в биохимию
Если в жизни есть магический компонент, то, безусловно, можно привести аргумент в пользу того, что это катализ. Благодаря катализу реакции, на завершение которых в некатализируемом «реальном мире» могут уйти сотни лет, в присутствии катализатора происходят за считанные секунды. Химические катализаторы, такие как платина, могут ускорять реакции, но ферменты затмевают химические катализаторы (рис. 4.1).
Рисунок 4.1 – Повышение скорости для нескольких ферментов Изображение Aleia Kim
Каким образом ферменты могут до такой степени ускорять реакции? Химические реакции следуют универсальной тенденции движения к более низкой энергии, но они часто имеют энергетический барьер, который необходимо преодолеть. Секрет каталитического действия заключается в уменьшении величины этого барьера. Когда барьер снижен, реакция протекает быстрее.
Чтобы лучше понять это явление, стоит уделить минутку обсуждению концепции равновесие .
Когда биохимическая реакция находится в равновесии, концентрации реагентов и продуктов не меняются с течением времени. Это не означает, что реакции остановились, а скорее то, что прямая реакция и обратная реакция достигли точки, в которой прямая реакция протекает с той же скоростью, что и обратная. : Если бы у вас было 8 молекул А и 4 молекулы В в начале, и 2 молекулы А превратились в В, а 2 молекулы В одновременно превратились обратно в А, то количество молекул А и В осталось бы неизменным , т. е. реакция находится в равновесии.
В жонглировании можно установить состояние, очень похожее на химическое равновесие, когда у каждого из нескольких жонглеров есть 2 кегли, но кегли всегда подбрасываются и ловятся. scragz, CC BY 2.0
Обратите внимание, что часть «equi» в этом слове относится к равному, как можно было бы ожидать, но это не так. относятся к абсолютным концентрациям.
Биохимические реакции, когда они не находятся в равновесии, имеют тенденцию двигаться в направлении равновесия. Таким образом, химические реакции с участием ферментов часто протекают в среде, где концентрации реагентов меняются, а поток реагентов в продукты находится под влиянием других связанных реакций в так называемом биохимическом или метаболическом пути.
Таким образом, химические реакции с участием ферментов часто протекают в среде, где концентрации реагентов меняются, а поток реагентов в продукты находится под влиянием других связанных реакций в так называемом биохимическом или метаболическом пути.
Энергия активации
На рис. 4.2 схематически изображены изменения энергии, происходящие при протекании простой реакции. Чтобы реакция пошла, необходимо преодолеть энергию активации, чтобы реакция произошла.
Рисунок 4.2 – Изменение энергии в ходе некаталитической реакции. Изображение Aleia Kim
На рис. 4.3 наложена энергия активации катализируемой реакции. Как видите, реагенты начинаются с одного и того же уровня энергии (одно и то же место на оси Y) как для катализируемых, так и для некаталитических реакций, а продукты заканчиваются с одинаковой энергией как для катализируемых, так и для некаталитических реакций. Однако катализируемая реакция имеет более низкую энергию активации (пунктирная линия), чем некатализируемая реакция.
Рисунок 4.3 – Изменение энергии в ходе некаталитической реакции (сплошная зеленая линия) и катализируемой реакции (зеленая пунктирная линия). Изображение Алеи Ким
Обратимость
Отношение реагентов к продуктам в состоянии равновесия является функцией величины разницы энергий между состояниями продукта и реагента, показанной как различное расположение по оси Y на графиках выше. Чем ниже энергия продуктов по сравнению с реагентами, тем больше процент молекул, которые будут продуктами при равновесии.
Поскольку фермент снижает энергию активации реакции, он может ускорить обратную реакцию точно так же, как он ускоряет реакцию в прямом направлении. Однако при равновесии не происходит изменения концентрации реагентов и продуктов. Таким образом, ферменты ускоряют время, необходимое для достижения равновесия, но не влияют на соотношение продуктов и реагентов при равновесии.
Отношение продуктов к реагентам можно рассматривать как своего рода «цель» реакции, хотя, конечно, молекулы и атомы не являются живыми существами и на самом деле не имеют желаний.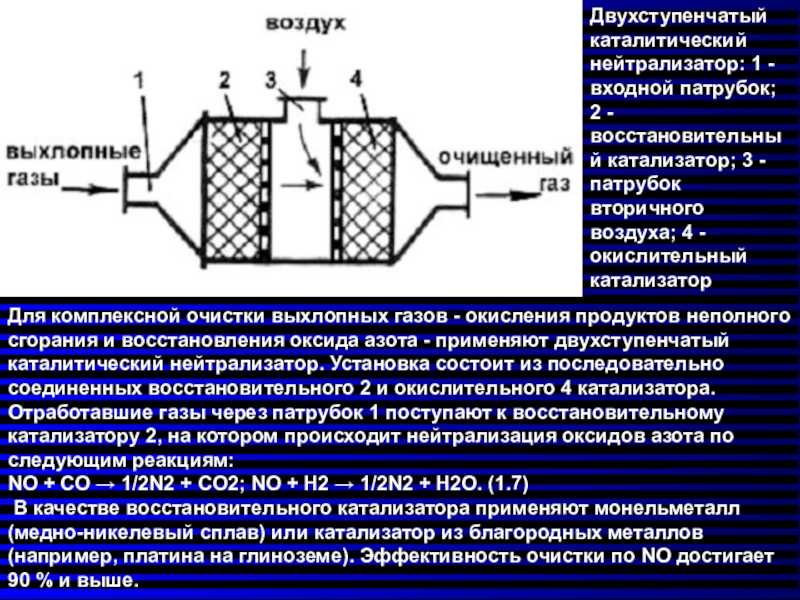 Но это состояние, к которому склонны реакции. Когда происходят изменения в системе, находящейся в равновесии, реакция будет протекать таким образом, чтобы восстановить это равновесное соотношение.
Но это состояние, к которому склонны реакции. Когда происходят изменения в системе, находящейся в равновесии, реакция будет протекать таким образом, чтобы восстановить это равновесное соотношение.
В частности, в биохимических путях несколько реакций связаны так, что продукт одной реакции является реагентом другой. Когда продукт удаляется из первой реакции, эта система выходит из своего равновесного состояния, и реакция будет продолжаться, превращая дополнительный реагент в продукт, чтобы работать в направлении равновесного соотношения.
Исключения
В некоторых реакциях выделяется такое большое количество энергии (падение вниз на графиках), что обратные реакции практически невозможны. В этих случаях соотношения равновесия сильно смещены в сторону продуктов. 9+[/latex]
В прямом направлении углекислота получается из воды и углекислого газа. Он может либо оставаться неповрежденным в растворе, либо ионизироваться с образованием бикарбонат-иона и протона. В обратном направлении образуются вода и углекислый газ. Углекислый газ, конечно же, является газом и может выйти из раствора и улетучиться.
В обратном направлении образуются вода и углекислый газ. Углекислый газ, конечно же, является газом и может выйти из раствора и улетучиться.
Когда реакционные молекулы удаляются, как это было бы при утечке углекислого газа, реакция тянется в направлении потерянной молекулы, и обращение не может произойти, если отсутствующая молекула не будет заменена. Во второй реакции, протекающей справа, угольная кислота (h3CO3) «удаляется» путем ионизации. Это также ограничило бы реакцию, возвращающуюся к углекислому газу в воде. Этот последний тип «удаления» происходит в метаболических путях. В этом случае продукт одной реакции (угольная кислота) является субстратом для следующей (образование бикарбоната и протона).
В метаболическом пути гликолиза таким образом связаны десять реакций, и обратить процесс вспять гораздо сложнее, чем если бы рассматривалась только одна реакция.
Общие механизмы действия
Теперь мы видели, что реакции, катализируемые ферментами, протекают на порядки быстрее, чем некатализируемые и химически катализируемые реакции. И этот процесс был объяснен с использованием понятий, связанных с энергией и равновесием. Но магию ферментативного катализа можно рассматривать и с другой точки зрения: что делает отдельный фермент, чтобы снизить энергетический барьер активации реакции?
И этот процесс был объяснен с использованием понятий, связанных с энергией и равновесием. Но магию ферментативного катализа можно рассматривать и с другой точки зрения: что делает отдельный фермент, чтобы снизить энергетический барьер активации реакции?
Изменения
Одна из замечательных особенностей катализаторов заключается в том, что они не являются реагентами в обычном смысле: они не расходуются во время реакции. Другими словами, катализатор заканчивается после реакции точно так же, как она началась. Ферменты разделяют это свойство, хотя в процессе каталитического действия фермент временно изменяется. На самом деле именно способность фермента изменяться приводит к его невероятной эффективности.
Эти изменения могут быть тонкими электронными, более значительными ковалентными (связывающими) модификациями или структурными изменениями, возникающими из-за гибкости, присущей ферментам. Такие корректировки невозможны для химических катализаторов, таких как металлическая платина.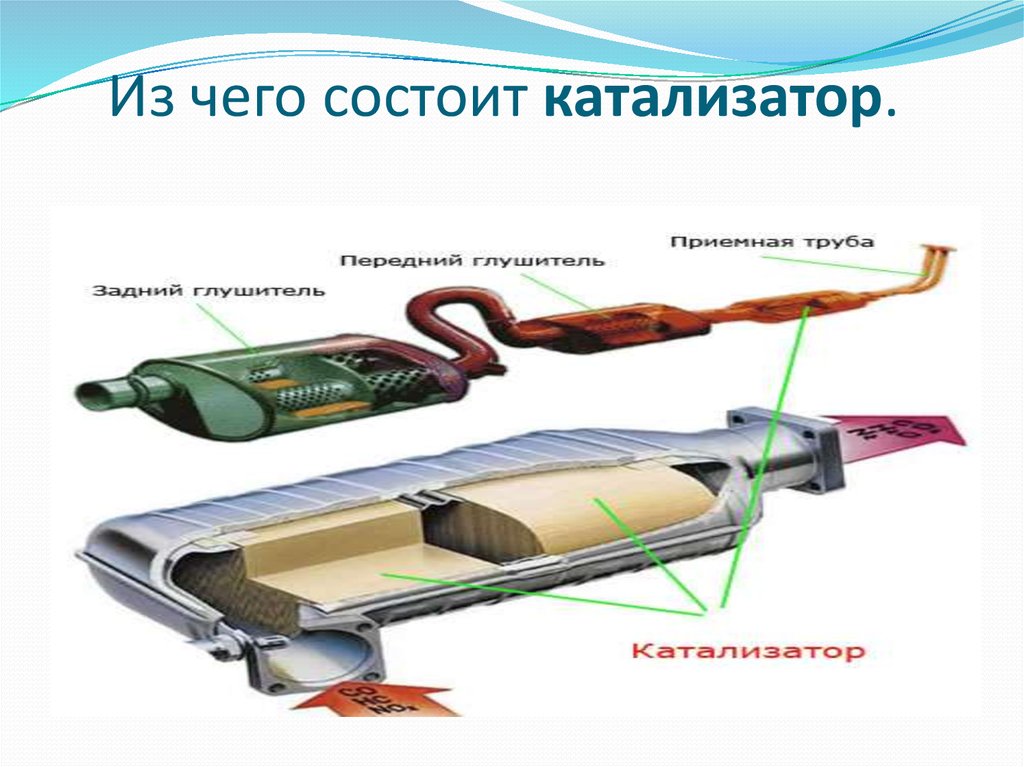 Гибкость ферментов позволяет двигаться, а движение способствует изменению электронной среды, необходимой для катализа. Таким образом, ферменты гораздо более эффективны, чем жесткие химические катализаторы, благодаря их способности облегчать изменения, необходимые для оптимизации каталитического процесса.
Гибкость ферментов позволяет двигаться, а движение способствует изменению электронной среды, необходимой для катализа. Таким образом, ферменты гораздо более эффективны, чем жесткие химические катализаторы, благодаря их способности облегчать изменения, необходимые для оптимизации каталитического процесса.
Ферменты представляют собой большие и сложные молекулы, что является структурной основой этого различия. Эта сложность также означает, что возможно огромное разнообразие ферментов, каждый из которых обладает тщательно настроенной способностью проводить определенные реакции с большой эффективностью и высокой селективностью, работая только с определенными очень специфическими реагентами для превращения их в определенные продукты.
Связывание субстрата и активный сайт
Ферменты имеют сайты связывания, которые не только избирательно «захватывают» реагент (называемый a при обсуждении ферментов), но также помещают его в положение, позволяющее электронно индуцировать реакцию либо внутри себя, либо с другим подложка.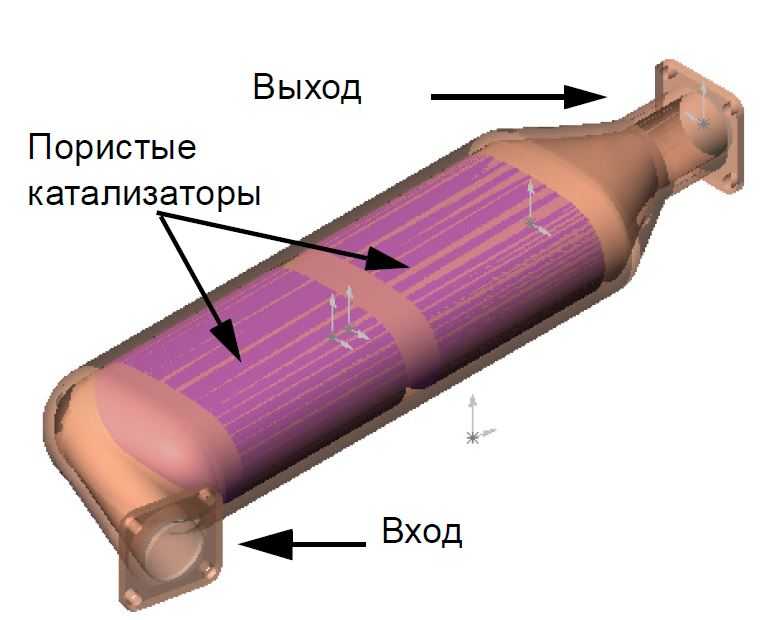
Сам фермент может играть роль в сдвигах электронов, или этот процесс может происходить в результате очень близкой ориентации субстратов друг к другу.
Место на ферменте, где связывается субстрат ( ), также обычно является местом самой реакции, называемым .
Гибкость ферментов
Будучи большими и сложными молекулами, ферменты в некоторой степени гибки и реагируют на местное окружение. Незначительные изменения формы, часто возникающие из-за связывания самого субстрата, помогают оптимально расположить субстраты для реакции после их связывания.
Рисунок 4.4 – Связывание субстрата метилентетрагидрофолатредуктазой
Рисунок 4.5 – Лизоцим с сайтом связывания субстрата (синий), активным центром (красный) и связанным субстратом (черный). Википедия
Индуцированное соответствие
Эти изменения формы частично объясняются моделью катализа с индуцированным соответствием (рис. 4.6), которая показывает, что не только ферменты изменяют субстраты, но и субстраты также временно изменяют структуру фермента.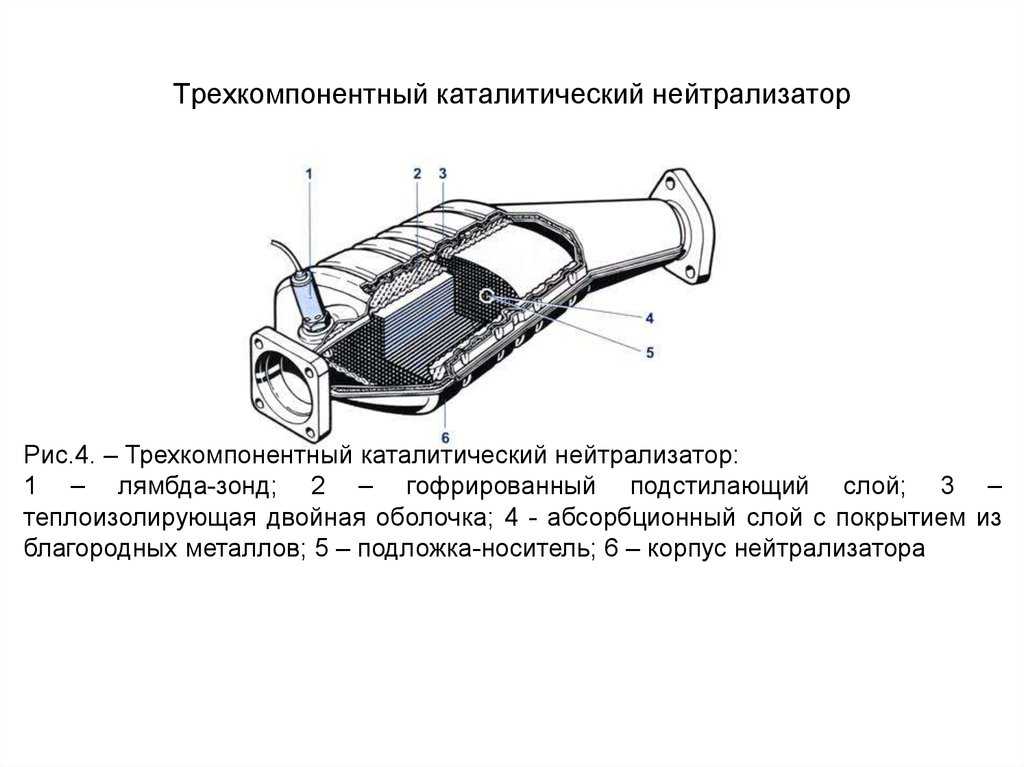 По окончании катализа фермент возвращается в исходное состояние. Эта модель контрастирует с моделью замка и ключа, которая представляет ферменты фиксированной формы, идеально подходящей для связывания своего субстрата (субстратов). Доказательства поддерживают модель Induced Fit как лучшее и более верное описание реальности.
По окончании катализа фермент возвращается в исходное состояние. Эта модель контрастирует с моделью замка и ключа, которая представляет ферменты фиксированной формы, идеально подходящей для связывания своего субстрата (субстратов). Доказательства поддерживают модель Induced Fit как лучшее и более верное описание реальности.
Гибкость фермента также играет важную роль в контроле активности фермента. Ферменты чередуются между состоянием T (напряженным), которое является состоянием с более низкой активностью, и состоянием R (расслабленным), которое имеет большую активность.
Рисунок 4.6 – Модель замка и ключа Фишера (слева) в сравнении с моделью ключа Фишера. Модель индуцированного соответствия Кошланда (справа). Изображение Алеи Ким
Заказанный переплёт
Некоторым ферментам необходимо связывать несколько субстратов, например, если они катализируют реакцию, в которой два субстрата ковалентно связаны. Для этих систем связывание первого субстрата вызывает структурные изменения в ферменте, необходимые для связывания второго субстрата. Эти механизмы согласуются с моделью Induced Fit, где ферменты способны приспосабливаться к начальному связыванию и, таким образом, с большей вероятностью связываются со вторым субстратом. 9+[/latex]
Эти механизмы согласуются с моделью Induced Fit, где ферменты способны приспосабливаться к начальному связыванию и, таким образом, с большей вероятностью связываются со вторым субстратом. 9+[/latex]
Этот фермент требует, чтобы NADH связывался до связывания пирувата. Как отмечалось ранее, это согласуется с индуцированной моделью катализа. В этом случае связывание NADH изменяет форму/окружение фермента, так что пируват может связываться, а без связывания NADH субстрат не может получить доступ к сайту связывания пирувата.
Типы реакций
Катализируемые ферментами реакции могут быть нескольких типов, как показано на рис. 4.7. В одном механизме, называемом последовательными реакциями, в какой-то момент реакции оба субстрата будут связаны с ферментом. В свою очередь, это может происходить двумя разными способами — случайным и упорядоченным.
| Типы реакций | |
|---|---|
| Одна подложка — один продукт | А ⇄ В |
| Один субстрат – несколько продуктов | А ⇄ В + С |
| Несколько подложек – отдельные продукты | А + В ⇄ С |
| Несколько подложек — несколько продуктов | А + В ⇄ С + Г |
Коэнзимы
Органические молекулы, помогающие ферментам и способствующие катализу, называются . Термин кофактор представляет собой широкую категорию, обычно подразделяемую на неорганические ионы и коферменты. Если кофермент очень прочно или ковалентно связан с ферментом, его называют . Ферменты без их кофакторов неактивны и называются . Ферменты, содержащие все свои кофакторы, называются.
Термин кофактор представляет собой широкую категорию, обычно подразделяемую на неорганические ионы и коферменты. Если кофермент очень прочно или ковалентно связан с ферментом, его называют . Ферменты без их кофакторов неактивны и называются . Ферменты, содержащие все свои кофакторы, называются.
Рисунок 4.27 – Кофакторы ферментов. Изображение Алеи Ким
Рисунок 4.28 – Коэнзим А (КоА)
Некоторые коферменты являются производными витаминов. Витамины представляют собой органические молекулы, необходимые в рационе для нормальной биохимической функции. Химические структуры витаминов представляют собой каркасы, которые организм не может построить самостоятельно в достаточном количестве. Витамины, какими мы их знаем (витамин А, витамин D и т. д.), часто являются названиями, которые относятся к небольшим группам близкородственных химических структур, любая из которых может выполнять определенную роль в нашем организме.
Витамины могут подвергаться химической модификации, прежде чем играть определенную роль в организме. Например, ниацин (витамин B3) может быть химически преобразован в никотинамидадениндинуклеотид (NAD+), ключевую молекулу энергетического метаболизма.
Например, ниацин (витамин B3) может быть химически преобразован в никотинамидадениндинуклеотид (NAD+), ключевую молекулу энергетического метаболизма.
Витамины часто входят в состав коферментов, подобных этому. Однако не все витамины служат коферментами, и не все коферменты происходят из витаминов. Термин «витамин» происходит от «витального амина», что указывает на потребность в потреблении, чтобы жить («жизненно важный»), и на их химический состав как на амин — еще одно указание, которое включает многие, но не все химические вещества в этом группа.
Среди кофакторов, перечисленных в таблице на рис. 4.27, много веществ, полученных из витаминов: каждое вещество, названное в списке коферментов, содержит большой фрагмент, который происходит от одного из витаминов группы В.
Рибозимы
Почти все ферменты являются белками. Однако некоторые молекулы РНК также способны ускорять реакции.
Самая известная из этих молекул была обнаружена Томом Чехом в начале 1980-х годов. Чех был озадачен своей неспособностью найти какие-либо белки, катализирующие процесс, который его группа изучала в микроорганизме под названием Tetrahymena. В конечном итоге было установлено, что катализ исходит от самой РНК. После этого открытия было обнаружено много других примеров каталитических РНК. Каталитические молекулы РНК известны как рибозимы.
Чех был озадачен своей неспособностью найти какие-либо белки, катализирующие процесс, который его группа изучала в микроорганизме под названием Tetrahymena. В конечном итоге было установлено, что катализ исходит от самой РНК. После этого открытия было обнаружено много других примеров каталитических РНК. Каталитические молекулы РНК известны как рибозимы.
359
Рисунок 4.31 – Расщепление РНК рибозимом. Wikipedia
Рисунок 4.32 – Рибозим Hammerhead. Википедия
Обычное дело
Рибозимы, однако, не редкость в природе. Белковые рибосомы клеток по существу представляют собой гигантские рибозимы. 23S рРНК прокариотической рибосомы и 28S рРНК эукариотической рибосомы катализируют образование пептидных связей.
Рибозимы также важны для нашего понимания эволюции жизни на Земле. Было показано, что они способны посредством отбора развивать самовоспроизведение. Действительно, рибозимы на самом деле отвечают на дилемму курица/яйцо — что было раньше, ферменты, выполняющие работу клетки, или нуклеиновые кислоты, несущие информацию, необходимую для производства ферментов.

 Металл не способен образовывать мелкие частицы, поэтому для двигателя он не представляет опасности.
Металл не способен образовывать мелкие частицы, поэтому для двигателя он не представляет опасности.


 Изменения pH могут денатурировать ферменты, изменяя заряд фермента. Это изменяет ионные связи фермента, которые способствуют его функциональной форме.
Изменения pH могут денатурировать ферменты, изменяя заряд фермента. Это изменяет ионные связи фермента, которые способствуют его функциональной форме. pdf
pdf