Содержание
Для чего служит автокатализатор, роль, назначение, функции
У современных машин, работающих на бензиновых или дизельных моторах, в обязательном порядке в выхлопной имеются каталитические нейтрализаторы (КН). При этом сажевые фильтры предусмотрены в машинах первого плана, а ТС второго плана оснащены фильтрами из металла или керамики. Для чего служит катализатор?
Задача устройств заключается в том, чтобы снизить количество отравляющих элементов, которые попадают в окружающую среду вместе с выхлопными газами.
Как работает и устроен каталитический нейтрализатор
Вначале в устройстве происходит фильтрация выхлопных газов, а затем их дальнейшая регенерация. В процессе работы стенки фильтра постепенно загрязняются, так как на них остаются продукты горения. Как результат — внутри катализатора происходит скопление вредных для человека отходов, мешающих выходу в атмосферу отработанных выхлопных газов. Это негативным образом влияет на мощность мотора. Вывод: замену изношенного катализатора следует проводить как можно быстрее, при первых признаках его выхода из строя.
Вывод: замену изношенного катализатора следует проводить как можно быстрее, при первых признаках его выхода из строя.
Внутри фильтрующие устройства покрываются специальным каталитическим слоем. Когда он соприкасается с раскалёнными химическими веществами, возникающими в процессе сгорания топлива, то возникает химическая реакция с последующим обезвреживанием опасных элементов.
Каталитический нейтрализатор находится недалеко от силового агрегата автомобиля, сразу позади коллектора выпуска. Именно там температура выхлопных газов максимально высокая.
Главная составная часть фильтра, изготовленного из керамики — особая матрица из такого же материала, представляющая собой мелкоячеистую структуру. В ней расположены каналы, имеющие очень маленькое сечение. Каналы имеют пористые стенки и обладают функцией фильтра. Для ускорения протекания химических реакций на поверхность керамических сот нанесены драгоценные металлы. Сама матрица облачена в прочный герметичный корпус. Что касается металлических аналогов, то блоки у них тоже металлические и имеют такое же каталитическое покрытие.
Причины, по которым нейтрализатор выходит из строя
От того, в каком состоянии находится каталитический нейтрализатор автомобиля, напрямую зависит расход бензина или дизельного топлива. При забитом устройстве работа машины становится хуже. Теоретически нейтрализаторы рассчитаны примерно на 100 000 или 120 000 км пробега, после чего их нужно менять. Слой, состоящий из драгметаллов, который производители наносят на керамику, становится слишком тонким. Своих функций изношенный катализатор выполнять уже не может.
Можно ли удалять катализатор? Да, но стоит помнить о последствиях. В первую очередь выхлопы будут попадать в атмосферу, загрязняя ее. Во-вторых, ваше авто не пройдет техосмотр. В-третьих, при недостаточной изоляции салона токсичный дым будет просачиваться в салон, вызывая тошноту и головную боль. В четвертых, надо быть готовым к затратам на перепрошивку ЭБУ и монтаж «альтернативы» для корректной работы авто.
Бывают и случаи, когда нейтрализатор нуждается в ремонте или замене намного раньше установленных сроков.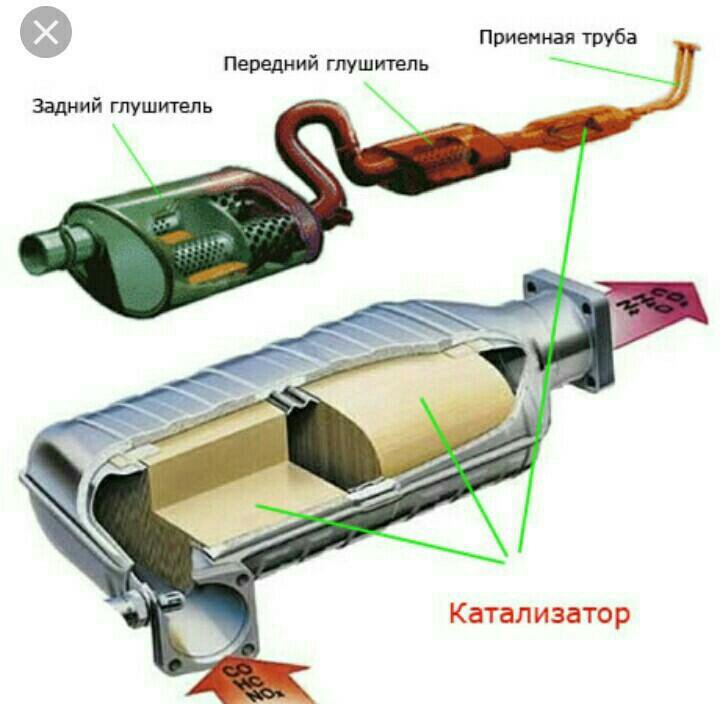 В качестве причин его преждевременного износа часто выступают:
В качестве причин его преждевременного износа часто выступают:
- топливо низкого качества. Если горючее плохое, то в нём содержится большое количество свинца, «убивающего» катализатор, быстрее засоряя соты;
- высокий расход масла в двигателе, когда он неисправен. Происходят сгорание лишнего масла в цилиндрах и его попадание в выхлопную систему;
- пропуск зажигания. Сгорания бензина в цилиндрах не происходит, а остаточные горючее и масло быстро засоряют систему выхлопа, разрушая нейтрализатор;
- повреждения механического плана. Поскольку катализаторы очень хрупкие, их могут легко вывести из строя агрессивная езда водителя или неправильная эксплуатация транспортного средства.
Важно помнить о том, что в более чем 80% случаев, когда катализатор неисправен, приходится полностью менять мотор.
Основные симптомы забитых преобразователей
Для предотвращения поломки нужно своевременно диагностировать машину и знать о том, как выглядят основные симптомы выхода из строя каталитического нейтрализатора:
- при запуске силовой агрегат мотор работает плохо и быстро глохнет, а на панели загорается световой индикатор Check Engine, который имеет прямое отношение к двигателю.
 Выхлопы выходят из трубы очень слабо;
Выхлопы выходят из трубы очень слабо; - машина теряет мощность и динамику езды. Когда водитель нажимает на газ, она даёт слабый отклик. Расход топлива и масла становится больше;
- при холодном пуске мотора в салоне возникает характерный резкий запах: верный признак того, что катализатор разрушен.
Также, когда двигатель перегазовывают или разгоняют, это сопровождается характерным металлическим звуком.
Плюсы сотрудничества с нашей компанией
Автокатализатор — это фильтр и он имеет определённый срок службы. Когда происходит засорение КН, то автомобиль теряет показатели своей мощности. Расход бензина становится намного выше, износ агрегатов и узлов происходит гораздо быстрее. Для предотвращения подобных ситуаций фильтр следует заменить или удалить полностью.
Катализатор, вышедший из строя, необходимо правильно утилизировать. Это не бытовой мусор, ему несвойственно естественное разложение. Нейтрализаторы относят к классу токсичных отходов, поэтому для их сдачи нужно найти специальный приёмный пункт.
Наша фирма готова купить у вас старый катализатор, предложив за него выгодное вознаграждение. Что касается размера денежной компенсации, то он будет определён после того, как мастер тщательно изучит устройство уже на месте.
Мы всегда готовы купить бу катализатор как от российских, так и от импортных автомобилей. Неважно, в каком состоянии они находятся. Устройства могут быть битыми, измельчёнными, колотыми и т.д. Обращайтесь к нам, если вы заметили характерные признаки выхода нейтрализатора из строя, и мы предложим водителям выгодные условия покупки. Расчёт стоимости бу катализатора наш сотрудник проводит при клиенте. Проверяя отработанные катализаторы, мы используем спектральный анализ, позволяющий точно определить, сколько они стоят. На сумму влияет и то, какое количество драгметаллов осталось в устройстве, а также год, в котором был выпущен автомобиль, и объём мотора.
Удалять или оставлять катализатор
Удалять или оставлять катализатор
Специалисты компании «Авангард Авто» на этот раз разбираются в аспектах вопроса о такой популярной ныне услуге, как удаление катализатора. Статей по данной теме приведено большое количество, но мы решили в своей статье наиболее подробно разобрать этот вопрос, основываясь на личный опыт.
Статей по данной теме приведено большое количество, но мы решили в своей статье наиболее подробно разобрать этот вопрос, основываясь на личный опыт.
Катализатор или каталитический нейтрализатор – часть выхлопной системы автомобиля, которая служит только для одной цели – снижение вредных веществ в выхлопе.
Устройство катализатора автомобиля простое. Он представляет собой трубку, состоящую из мелких керамических или металлических «сот». Стенки ячеек покрыты активной смесью, которая и взаимодействует с выхлопами. Проходя через трубку, воздух очищается, и из выхлопной трубы в атмосферу поступает гораздо меньше токсичных веществ.
Если катализатор оплавился или забился, то отработанные газы не могут через него нормально пройти, а это означает, что часть возвращается обратно в камеру сгорания и делает вновь поступившую горючую смесь менее эффективной. Таким образом, мотор душит сам себя.
Катализатор нужно менять довольно часто – каждые 100-150 тысяч км пробега. Именно за это время он успевает полностью исчерпать свой ресурс. Дело в том, что в нем идет химическая реакция, которая связывает определенные соединения из выхлопных газов. Как только активные реагенты заканчиваются, устройство становится бесполезным.
Именно за это время он успевает полностью исчерпать свой ресурс. Дело в том, что в нем идет химическая реакция, которая связывает определенные соединения из выхлопных газов. Как только активные реагенты заканчиваются, устройство становится бесполезным.
Но кроме этого, есть несколько причин, по которым каталитический нейтрализатор нужно будет заменить, не дожидаясь указанного пробега. Ускоренный износ устройства возможен при таких условиях:
-
Регулярная езда по очень плохим дорогам. Постоянная тряска по камням, ухабам и неровным грунтовкам может приводить к тому, что керамические ячейки просто разбиваются и перестают выполнять свою функцию. -
Привычка постоянно резко вдавливать педаль газа в пол. В такой ситуации топливная смесь не успевает полностью сгорать, ее остатки также постепенно закупоривают «соты» нейтрализатора. -
Неполадки в двигателе. Если в самом моторе или системе зажигания есть проблемы, недогоревшее топливо и масло могут попадать в катализатор, забивая мелкие ячейки.
-
Некачественное топливо или различные зимние добавки. В них содержатся примеси свинца и других тяжелых металлов, что сокращает срок жизни очистителя выхлопных газов. -
Постоянные пробки. Пока авто стоит в заторе, его двигатель все равно работает, соответственно, идет и выхлоп отработанного газа. Ресурс катализатора расходуется быстрее рекомендованного пробега.
Чаще всего катализаторы стоят на авто, которые уже оснащены электронной системой распознавания неполадок. Поэтому при возникновении проблем с катализатором на панели загорится «Check Engine». К тому же, производители встраивают специальные кислородные датчики. Если выхлопные газы перестают очищаться, некоторые машины автоматически перестают запускаться.
Кроме этого, есть еще несколько признаков, по которым можно понять, что нейтрализатор выхлопных газов пора менять. В первую очередь, снизится мощность мотора, машина начнет хуже разгоняться. Появятся проблемы с запуском двигателя «на холодную» и повысится расход топлива. Также может появиться грохот во время старта авто. Все это происходит из-за того, что выхлопные газы не могут нормально выйти через забитую сетку и возвращаются назад в камеру сгорания – двигатель «задыхается».
Также может появиться грохот во время старта авто. Все это происходит из-за того, что выхлопные газы не могут нормально выйти через забитую сетку и возвращаются назад в камеру сгорания – двигатель «задыхается».
Удалить и заменить неисправную деталь обязательно нужно после того, как нейтрализатор выхлопных газов исчерпал свой ресурс. Это делается либо после определенного пробега, либо если уже наблюдаются явные признаки его неисправности. Если этого не сделать, авто начнет сильнее расходовать топливо, хуже стартовать и разгоняться, а некоторые модели и вовсе перестанут заводиться. Самый простой выход – просто купить новый катализатор и установить его вместо отработавшего. Но такая деталь стоит дорого из-за содержащихся в ней драгоценных металлов.
Но как быть дальше? Скорее всего, вариант с покупкой новой детали на замену вам не подходит: новый катализатор стоит дорого, но при этом нет никаких гарантий, что он не выйдет из строя также быстро. Учитывая, что в некоторых автомобилях производители устанавливают несколько катализаторов, замена обойдется в круглую сумму, которая сопоставима со стоимостью подержанного автомобиля. Поэтому многие владельцы машин просто ставят обманки и используют пламегасители.
Поэтому многие владельцы машин просто ставят обманки и используют пламегасители.
Для владельцев машин преимуществ в удалении каталитического нейтрализатора выхлопных газов несколько:
-
не нужно покупать и регулярно менять недолговечную дорогую деталь; -
возрастает мощность двигателя; -
снижается расход топлива; -
уменьшается чувствительность к качеству топлива; -
мотор не «задыхается» из-за ухудшения отвода выхлопных газов.
Но несмотря на все достоинства удаления катализатора, у этой процедуры есть и ряд недостатков. В первую очередь, ухудшается состав выхлопа, и как результат – более разрушительное действие автомобиля на окружающую среду. А если по какой-то причине выхлопные газы попадают в салон, там может ощущаться неприятный запах.
Если катализатор удален некорректно или же неправильно установлен пламегаситель, на приборной панели могут постоянно гореть сообщения о неисправности двигателя. Кроме того, возникают сложности с техосмотром, а также может появиться неприятный дребезжащий звук во время езды.
Кроме того, возникают сложности с техосмотром, а также может появиться неприятный дребезжащий звук во время езды.
В завершении подытожим, что удалять или нет катализатор на вашем автомобиле — дело личное, но если вы решились на данную процедуру, но выбирать для этих работ необходимо сертифицированный автосервис, где специалисты дадут гарантию на выполненные работы, так как нередки случаи, когда автомобиль после удаления ведет себя непривычно, могут появляться ошибки на приборной панели. В таком случае обратиться за устранением этих неполадок можно по гарантии, не доказывая с пеной у рта, что вы уже были здесь и неполадка является следствием некачественной работы.
Каталитические металлы и их применение | Крот
Стивен Эшворт исследует катализаторы, очищающие выхлопные газы, в этой статье из серии «Лаборатория Авогадро»
Источник: © Shutterstock химические реакции за счет снижения энергетического барьера между реагентами и продуктами. Они не только экономят энергию, но и помогают производить чистый продукт вместо смеси.
В последней лаборатории Авогадро мы увидели, что ферменты, биологические катализаторы, очень эффективно выполняют свою работу. Однако химики используют самые разнообразные катализаторы, не являющиеся ферментами: многие из них основаны на переходных металлах. Эти металлы, такие как железо, никель и платина, находятся в длинном d-блоке в середине периодической таблицы.
Как они работают
Переходные металлы являются хорошими катализаторами, поскольку они могут существовать в виде двух (или более) разных ионов в соединениях, например оксид железа (II) (FeO) и оксид железа (III) (Fe 2 О 3 ). Говорят, что железо находится в разных степенях окисления в этих двух соединениях.
В некоторых реакциях железо действует как катализатор и снижает энергетический барьер, переходя из одной степени окисления в другую. Однако, когда реакция завершена, она возвращается в исходное состояние, так что она готова начать все сначала. Хотя катализаторы меняются во время реакции, они не расходуются в процессе.
Для чего они используются
Источник: © Shutterstock.
Нефтехимический завод. фармацевтическая индустрия.
В настоящее время большинство автомобилей оснащены каталитическим нейтрализатором для снижения вредных выбросов, производимых двигателем. В них используются мелкие частицы драгоценных металлов (таких как платина и родий, а также переходные металлы), встроенные в керамические соты. Эти маленькие частицы обеспечивают большую площадь поверхности – химические реакции по очистке выхлопных газов затем эффективно катализируются.
Одна из этих реакций каталитического нейтрализатора объединяет несгоревшее топливо с кислородом, в результате чего образуются вода и двуокись углерода. Эксперимент этого месяца делает нечто подобное, но позволяет нам увидеть, как металл меняет степень окисления, поскольку он катализирует реакцию.
Светящаяся медь
Обычно в лаборатории Авогадро мы хотели бы дать вам эксперимент, чтобы попробовать себя, однако этот эксперимент безопаснее, если его проводит в научной лаборатории опытный химик: в нем используется раскаленный докрасна металл с легковоспламеняющимся растворителем, а продукт реакции является раздражающим газом.
В ходе эксперимента кусок меди (возможно, монету) нагревают до красна, а затем помещают в коническую колбу над небольшим количеством ацетона. Пары ацетона реагируют с кислородом в колбе, используя медь в качестве катализатора, с образованием метана и кетена. Волны цвета рябят по поверхности меди, и кажется, что она светится, поскольку она меняет степень окисления во время реакции. Если вы поднимете медную монету обратно из колбы и подальше от паров ацетона, она вернется к своему первоначальному цвету, показывая, что она вернулась в исходное состояние.
Посмотрите эксперимент
Посмотрите видео ниже, чтобы своими глазами увидеть реакцию.
Источник: Королевское химическое общество
В этой демонстрации медь используется для окисления ацетона посредством гетерогенного катализа.
Дополнительная информация
Первоначально эта статья была опубликована в The Mole , студенческом журнале, издававшемся Королевским химическим обществом с 2012 по 2015 год.
Темы
- Катализ
- Материалы
Основы катализаторов — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 39040
Вопросы для обсуждения
- Что такое химическая абсорбция и как она способствует химическим реакциям?
- Какие виды хемосорбции приводят к отравлению катализатора?
- Как переходные металлы выбираются в качестве катализаторов?
- Что такое синтетические газы и как их готовят?
- Почему металлические кластеры могут быть превосходными потенциальными катализаторами?
- Являются ли нестехиометрические оксиды потенциальными катализаторами окислительно-восстановительных реакций?
- Какой тип катализаторов можно изготовить из стехиометрических оксидов?
- Что такое фотокаталитические реакции?
Гетерогенные катализаторы
Катализатор – это вещество, отличное от продуктов реагентов, добавляемое в реакционную систему для изменения скорости химической реакции, приближающей ее к химическому равновесию. Он циклически взаимодействует с реагентами, способствуя, возможно, многим реакциям на атомном или молекулярном уровне, но не расходуется. Другая причина использования катализатора заключается в том, что он способствует производству выбранного продукта.
Он циклически взаимодействует с реагентами, способствуя, возможно, многим реакциям на атомном или молекулярном уровне, но не расходуется. Другая причина использования катализатора заключается в том, что он способствует производству выбранного продукта.
Катализатор изменяет энергию активации, E a , реакции, обеспечивая альтернативный путь реакции. скорость и константа скорости k реакции связаны с E a следующим образом:
скорость = k * функция концентрации — E a / R T )
где — это константа, связанная с частотой столкновений. Таким образом, изменение E a изменяет скорость реакции.
Катализатор в той же фазе (обычно жидкий или газовый раствор), что и реагенты и продукты, называется гомогенным катализатором .
Катализатор, который находится в отдельной фазе от реагентов, называется гетерогенным или контактным катализатором . Контактные катализаторы — материалы, способные адсорбировать на своей поверхности молекулы газов или жидкостей. Примером гетерогенного катализа является использование тонкоизмельченной платины для катализа реакции монооксида углерода с кислородом с образованием диоксида углерода. Эта реакция используется в каталитических нейтрализаторах, установленных в автомобилях, для удаления угарного газа из выхлопных газов.
Контактные катализаторы — материалы, способные адсорбировать на своей поверхности молекулы газов или жидкостей. Примером гетерогенного катализа является использование тонкоизмельченной платины для катализа реакции монооксида углерода с кислородом с образованием диоксида углерода. Эта реакция используется в каталитических нейтрализаторах, установленных в автомобилях, для удаления угарного газа из выхлопных газов.
Промоторы сами по себе не являются катализаторами, но повышают эффективность катализатора. Например, оксид алюминия Al 2 O 3 добавляют к тонкоизмельченному железу для повышения способности железа катализировать образование аммиака из смеси азота и водорода. Яд снижает эффективность катализатора. Например, соединения свинца отравляют способность платины как катализатора. Таким образом, этилированный бензин не должен использоваться для автомобилей, оборудованных каталитическими нейтрализаторами.
Поскольку гетерогенные катализаторы часто используются в высокотемпературных реакциях, они обычно представляют собой тугоплавкие (тугоплавкие) материалы, или же они могут быть нанесены на тугоплавкие материалы, такие как оксид алюминия.
Сегодня проектирование катализаторов является сложной задачей для химиков и инженеров в плане эффективного производства, предотвращения загрязнения и переработки отходов.
Что такое химическая абсорбция и как она способствует химическим реакциям?
Как упоминалось в случае твердых дефектов, твердые поверхности являются двумерными дефектами. Они предлагают потенциал для притяжения к молекулам газов и жидкости. Адсорбция происходит, когда молекулы притягиваются к поверхности, а когда молекулы проникают сквозь толщу материала, используется термин абсорбция. Абсорбция без образования или разрыва химических связей называется физической абсорбцией или физической сорбцией, тогда как хемосорбция относится к процессам, при которых образуются или разрываются новые связи.
Inorganic Chemistry от Swaddle (стр. 117) дает отличный пример, иллюстрирующий хемосорбцию водорода никелевым катализатором. Энергия связи H 2 составляет 435 кДж/моль. Таким образом, в реакции гидрирования энергия должна быть доступна для реакций:
H 2 -> 2 H, H = 435 кДж
| |
>C=C< + 2 H -> H-C—C-H
| |
В приведенной выше реакции энергия активации, E a близко к 435 кДж. Однако, когда водород поглощается никелем, разрыву связи Н-Н способствует ряд стадий.
Однако, когда водород поглощается никелем, разрыву связи Н-Н способствует ряд стадий.
2 Ni + H 2 —>2 Ni…H 2 —-> 2 Ni-H
физическая сорбция твердого газа хемосорбция
Таким образом, энергия активации снижается из-за образования Ni -Н связи. Изменение энергии активации изменяет скорость реакции.
При активации O 2 металлом M связь O=O ослабляется или разрывается посредством следующих стадий:
О=О О—О О О О- О-
| | || || | |
-M—M- ==> -M—M- ==> -M M- ==> -M M-
На этих стадиях кислород активируется на различных стадиях.
С помощью сложных экспериментальных методов мы можем детально изучить хемосорбированные частицы. Например, считается, что хемосорбированный этилен представляет собой этилидиновый радикал
Ч Ч Ч Ч
\ | /
С
|
С
/|\
ПтПтПтПтПт
Металл Металл Металл
Хемосорбированный этилидуновый радикал.
Какие виды хемосорбции приводят к отравлению катализатора?
Если абсорбированные вещества очень стабильны и в процессе хемосорбции выделяется много энергии, поглощенные вещества не являются реакционноспособными. Их поглощение предотвращает дальнейшее поглощение других частиц, делая катализатор неактивным. Эти явления известны как отравление катализатора.
Яд снижает эффективность катализатора. Тетраэтилсвинец всегда был добавкой к бензину. Для защиты окружающей среды в автомобилях были установлены каталитические нейтрализаторы для окисления угарного газа и углеводородов. Однако соединения свинца отравляют способность платины как катализатора. Таким образом, этилированный бензин не следует использовать для автомобилей, оснащенных каталитическими нейтрализаторами.
На рынке представлено множество типов катализаторов, например, катализатор окисления MIRATECH также может снижать выбросы окиси углерода и углеводородов. Наиболее распространенный каталитический нейтрализатор использует металл Pt.
В последнее время возникает озабоченность по поводу снижения содержания серы в бензине и другом моторном топливе с целью снижения выбросов оксидов серы. Технически соединения серы не являются ядами для катализаторов (т. е. не вызывают необратимого снижения эффективности катализатора). Однако они будут занимать часть поверхности драгоценного металла, тем самым снижая активную конверсию выхлопных газов до тех пор, пока сера снова не будет десорбирована с участков драгоценного металла (краткосрочный эффект).
Как выбирают переходные металлы в качестве катализаторов?
Переходные металлы первого периода представлены этими металлами.
Sc Ti V Cr Mn Fe Co Ni Cu и Zn
Типичными общими чертами среди них являются наличие d электронов, а у многих из них и их незаполненных d орбиталей. В результате переходные металлы образуют соединения с различными степенями окисления. Таким образом, эти металлы представляют собой электронный банк , которые отдают электроны в подходящее время и хранят их для химических веществ в другое время.
Переходные металлы используются в реакциях гидрирования , упомянутых ранее. Эти реакции представлены
| |
>C=C< + 2 H -> H-C—C-H
| |
Например, таким применением является гидрогенизация ненасыщенного масла при производстве маргарина. Специальные катализаторы типа ИКТ-3-25-П изготовлены из палладия, нанесенного на специальный широкопористый углеродный носитель Сибунит.
Другими процессами, катализируемыми переходными металлами, являются реакции окисления-восстановления:
NH 3 + 5/4 O 2 = NO + H 2 O
2 CO + O 2 = 2 CO 2
часто, но не всегда используется в качестве катализатора в них. На изображении, показанном здесь, показан двойной каталитический нейтрализатор, показывающий путь потока газа.
Для большинства переходных металлов, кроме золота, хемосорбционная прочность соответствует общей последовательности для газообразных реагентов:
O 2 > алкины > алкены > CO > H 2 > CO 2 > N 2
Прочность при хемосорбции также зависит от металлов. В целом хемосорбция является наиболее сильной для металлов слева, а для переходных металлов она уменьшается в периоде с увеличением атомного номера:
В целом хемосорбция является наиболее сильной для металлов слева, а для переходных металлов она уменьшается в периоде с увеличением атомного номера:
Sc Ti V Cr Mn Fe Co Ni Cu Zn
Y Zr Nb Mo Tc Ru Rh Pd Ag Cd
La Hf Ta W Re Os Ir Pt Au Hg
Хемосорбция слишком сильна для групп Sc, Ti, V, Cr и Mn, и эти металлы не являются эффективными катализаторами.
- Fe, Ru и Os прочно хемосорбируют большинство газов и почти не хемосорбируют N 2 .
- Прочность Chemisorb для Co и Ni слабее, чем для группы Fe. Их поглощения для CO 2 и H 2 очень слабые.
- Rh, Pd, Ir и Pt едва хемосорбируют H 2 , но не CO 2 .
- Cu, Ag, слабо хемосорбируют СО и этилен.
Эти относительные силы хемосорбции позволяют нам сделать некоторые простые прогнозы относительно их пригодности в качестве катализаторов для конкретных реакций. Например, катализатор процесса Габера для производства аммиака должен хемосорбировать азот. Можно рассмотреть железо, рутений или осмий.
Например, катализатор процесса Габера для производства аммиака должен хемосорбировать азот. Можно рассмотреть железо, рутений или осмий.
Для реакций гидрирования катализатор должен хемосорбировать H 2 . Подходят металлы Co, Rh, Ir, Ni, Pd и Pt. Наличие и стоимость являются дополнительными факторами для рассмотрения. Никель на самом деле хороший выбор, если учесть все.
Эти рекомендации очень грубы, и каждый случай должен быть тщательно изучен. К счастью, многие катализаторы коммерчески доступны. Исследования и разработки катализаторов оставлены для многих компаний.
Что такое синтетические газы и как их готовят?
Синтез-газ — это общий термин, используемый для обозначения синтетических газов, подходящих в качестве топлива или для производства жидкого топлива. Часто это смесь H 2 и CO, и эта смесь может быть преобразована в метанол CH 3 OH. Хорошо известными катализаторами являются Pt и Rh, но другие технологии, такие как мембераны, также используются для производства синтез-газа.
Выбор катализатора играет важную роль в промышленном производстве. Например, использование родия или платины в качестве катализаторов показало очень различное распределение продуктов при использовании метана или этана.
CH 4 (65%) + O 2 (35%) —Rh—> H 2 (60%) + CO (30%) + CO 2 (2%) + H 2 ) (5%)
При использовании платины было получено больше нежелательных продуктов H 2 O и CO 2 . Свэддл описал разницу между использованием этих двух металлов в качестве катализаторов ( Неорганическая химия , стр. 120), но когда дело доходит до применения, требуется гораздо больше подробностей. Данные предоставили доказательства того, что небольшая разница в хемосорбции приводит к очень разным результатам.
Почему металлические кластеры могут быть отличными потенциальными катализаторами?
Площадь поверхности на единицу веса является важным фактором при использовании твердых веществ в качестве катализаторов. Существует много исследований, связанных с изучением площади поверхности твердых частиц металлов. Разработаны различные методы измерения площади поверхности твердых материалов. Одним из таких методов является определение площади поверхности по адсорбции газа.
Существует много исследований, связанных с изучением площади поверхности твердых частиц металлов. Разработаны различные методы измерения площади поверхности твердых материалов. Одним из таких методов является определение площади поверхности по адсорбции газа.
Кластеры представляют собой металлические частицы предельных размеров, каждая из которых состоит всего из нескольких атомов. Нет необходимости строго определять число атомов в частице, которое следует называть кластерами, но общее мнение состоит в том, что когда число атомов на поверхности частицы больше, чем число атомов в внутри , частица представляет собой кластер . Таким образом, кластер может состоять всего из 3 атомов и достигать нескольких десятков атомов.
Кстати, термин «кластер» использовался и в других областях исследования. Например, в металлоорганической химии соединения с несколькими металлами, связанными между собой связями металл-металл, также называются кластерами металлов. К этой категории относятся многие карбонильные соединения. Например,
К этой категории относятся многие карбонильные соединения. Например,
Co 2 (u-CO) 2 (CO) 6 , (u-CO означает CO, связанный мостиком между двумя атомами металла)
MN 2 (CO) 10
FE 3 (CO) 12
CO 4 (CO) 12
RH 4 (CO) 12
CHFE 4 (CO) 12
888. CO) 15
Rh 6 (CO) 16
Os 6 (CO) 18
Карбонилы металлов изучались как гомогенные катализаторы. Они упомянуты здесь, чтобы вы могли оценить их использование в других источниках.
Вся каталитическая активность происходит на поверхности, поскольку поверхностные атомы склонны к хемосорбции молекул газа. Таким образом, кластеры, естественно, будут превосходными потенциальными катализаторами. Таким образом, изучение гетерогенных катализаторов может включать изучение химии кластерных ионов металлов и инкапсулированных кластеров серебра в качестве катализаторов окисления. Кластеры могут быть получены путем осаждения из паровой фазы. Название этой ссылки звучит очень интересно: Metal Atom Vapor Chemistry: A Область ждет своего прорыва.
Кластеры могут быть получены путем осаждения из паровой фазы. Название этой ссылки звучит очень интересно: Metal Atom Vapor Chemistry: A Область ждет своего прорыва.
Являются ли нестехиометрические оксиды потенциальными катализаторами окислительно-восстановительных реакций?
Благодаря своей способности иметь различную степень окисления переходные металлы образуют нестехиометрические оксиды и обладают прекрасным потенциалом для окислительно-восстановительных (окислительно-восстановительных) реакций, поскольку они могут как отдавать, так и принимать электроны.
M n+ => M (n+1)+ + e —
M (n+1)+ + e — => M n+ 9000s Кроме того, они напоминают металл, , и они катализируют реакции гидрирования и изомеризации.
A оксид металла p-типа имеет избыточный положительный заряд в твердом теле и может адсорбировать кислород с образованием анионов, таких как O — , O 2- , O 2 — и O 2 2- на их поверхности. Оксид никеля является таким оксидом. Получается, что наиболее активны адсорбированные формы O — ,
Оксид никеля является таким оксидом. Получается, что наиболее активны адсорбированные формы O — ,
O 2 (г) + 2 Ni 2+ => 2 O — (адс) + 2 Ni 3+
2 О — (объявления) + 2 CO (объявления) => 2 CO 2 + 2 e —
2 Ni 3+ + 2 e — => 2 Ni 2+
Когда оксид дает кислорода, электроны остались позади, а отрицательный заряд в нем делает его оксидом n-типа . Оксид цинка является таким оксидом n-типа , и механизм реакции можно представить следующим образом:
СО (г) + 2 O 2- (решетка) => СО ) + 2 е —
0.5 O 2 + 2 e — => O 2-
CO 3 2- (lattice) = CO 2 + O 2- (lattice)
Общая реакция представляет собой —
CO + 0,5 O 2 => CO 2
На этих первичных стадиях кислород расходуется посредством адсорбции на твердом веществе.
Сульфид, такой как MoS 2 , может терять атомы серы, превращаясь в твердое вещество n-типа , Mo 1+x S 2 или получить атом серы, чтобы стать p-типа твердым Mo 1-x S 2 , в зависимости от давления паров газа S 2 , окружающего твердое тело. Легирование MoS 2 оксидом также может сделать его твердым p-типа для катализатора.
Одним из полезных применений MoS 2 в качестве катализатора является снижение содержания серы в бензине. Например, циклический тиофен C 4 H 4 S можно превратить в углеводород с помощью P-Type MOS 2 ,
C 4 H 4 S + 4 H 2 == P-Type MOS 2 ==> C 4 H 2020202020202020202020202020202020202020202020202020202020202020202022 H 2 S
Это достигается с помощью типичного промышленного катализатора гидрообессеривания, который может содержать 14% MoO 3 и 3% CoO на носителе из оксида алюминия.
Какие типы катализаторов можно изготовить из стехиометрических оксидов?
Хорошо известно, что оксиды металлов растворяются в воде с образованием основных растворов, тогда как оксиды неметаллов растворяются в воде с образованием кислых растворов. Некоторые оксиды металлов, такие как Al 2 O 3 , Fe 2 O 3 , Cr 2 O 3 и т. д. растворяются в сильных кислотах и основаниях. Таким образом, мы можем разделить оксиды на кислотные и основные оксиды по каталитической активности.
Кислотные оксиды
кислых оксидов, таких как AL 2 O 3 и SIO 2 Катализируйте реакции дегидратации, такие как
R-CH 2 CH 2 OH (G) == (Al 2 CH 2 OH (G) == (Al 2 CH 2 OH (G) == (Al 2 CH 2 OH (G) == (Al 2 CH 2 OH (G) == (Al 2 O 3 , 600 K) ==> R-CH=CH 2
Если рассматривать оксид как кислоту Льюиса, он адсорбирует группу ОН, облегчая реакцию на следующих стадиях.
R -CH 2 CH 2 OH (G) => R -CH 2 -CH 2 + + OH — (Adsorbed)
R -CH 2 -CH 2 + => R-CH + -CH 3
R-CH + -CH 3 + OH — (адсорбированный) => H-CH=CH 2 2 O
Цеолиты, представляющие собой алюмосиликаты, действуют как кислотные катализаторы. Они также катализируют изомеризацию, крекинг, алкилирование и другие органические реакции.
Основные оксиды
Основные оксиды, такие как MgO и ZrO, благоприятствуют реакциям с участием анионных частиц . Когда протон Н + адсорбируется на поверхности рядом с ионом О 2- в оксиде металла, образуется группа ОН — , оставляя органическую молекулу отрицательным зарядом.
CH 3 -CH 2 -CN + MO (твердый) => -CH 2 -CH 2 CN + M-OH + (твердый)
=> CH
0 9 -CN + MOH 2 (твердый)
= + кислород => CH 2 =CH-CN + MO (твердый) + H 2 O (продукт)
В целом реакция представляет собой селективное окисление
CH 3 -CH 2 -CN + MO (твердый) + 0,5 O 2 => CH 2 =CH-CN + MO (твердый) + 0,5 H 2 O
Окисление устраняет два атома водорода на молекулу в процессе, и предложенный механизм предполагает двухэтапный процесс удаления.
Смеси основных оксидов использовались в качестве катализаторов при окислительном сочетании метана. В некоторых случаях для такого применения разрабатываются специальные реакторы и катализаторы. TAP Reactor — одно из таких приложений. В данном случае использовались цеолиты.
Что такое фотокаталитические реакции?
Реакции, вызванные фотонами, сгустками энергии излучения, называются фотолизом. Фотокаталитические реакции предполагают фотолиз в присутствии катализатора. Однако в большинстве случаев катализаторы представляют собой полупроводники, а реакции представляют собой реакции фотолиза с участием полупроводников. В этом аспекте фотокатализатор выполняет несколько иную функцию, чем в термическом химическом процессе.
Приведенное ниже моделирование показывает, что когда желтый луч попадает на полупроводник TiO 2 , электроны возбуждаются из валентной зоны в зону проводимости. Эта ширина запрещенной зоны составляет 3,2 В. Затем возбужденный электрон способствует образованию H 2 . Дырки забирают электроны из групп ОН — , превращая их в активные радикалы ОН. Радикалы распадаются с образованием O 2 или реагируют с CHCl 3 , превращая его в безвредный CO 2 , H + и Cl — . Это моделирование фотокатализаторов подготовлено японской группой и довольно хорошо иллюстрирует концепцию. На самом деле процесс довольно сложный.
Дырки забирают электроны из групп ОН — , превращая их в активные радикалы ОН. Радикалы распадаются с образованием O 2 или реагируют с CHCl 3 , превращая его в безвредный CO 2 , H + и Cl — . Это моделирование фотокатализаторов подготовлено японской группой и довольно хорошо иллюстрирует концепцию. На самом деле процесс довольно сложный.
При фоторазложении воды возбужденные электроны реагируют с ионами водорода (протонами) (отверстие) = H 2 O + 0,5 O 2
Таким образом, продукты H 2 и O 2 являются потенциальными видами топлива для производства энергии, особенно для топливных элементов.
Другой пример: фторборная кислота используется в гальванике и отделке металлов. Для очистки сточных вод этих производств требуется удаление фторборной кислоты. Существующие методы адсорбции, коагуляции, методы осаждения не работают. Так, было изучено фотокаталитическое разложение борфтористоводородной кислоты, которое показало, что TiO 2 весьма эффективен при легировании оксидами Cr и Fe. Приведенная выше ссылка показала, что легирование Cr или Fe резко повысило активность. Более того, 0,5 мас. % Cr/TiO2 и 1,0 мас. % Fe/TiO2 показали максимальную активность 61 % и 41 % соответственно.
Приведенная выше ссылка показала, что легирование Cr или Fe резко повысило активность. Более того, 0,5 мас. % Cr/TiO2 и 1,0 мас. % Fe/TiO2 показали максимальную активность 61 % и 41 % соответственно.
Недавно в новостной статье была заманчивая претензия на Внутренний Воздухоочиститель. Судите сами, стоит ли это исследовать.
Пример 1
Энергетическая щель TiO 2 составляет 3,2 В. Какова частота фотонов, обладающих достаточной энергией для возбуждения электронов из ковалентной зоны TiO 2 в зону проводимости?
Решение
Энергия возбуждения электрона до 3,2 В составляет 3,2 эВ.
1,6022e-19 Дж 1
3,2 эВ ————- ————- = 7,74e14 Гц
1 эВ 6,626e-34 Дж с
ОБСУЖДЕНИЕ
Длина волны этих фотонов
3e8 м/с
——— = 387e9 м (или 387 нм)
7,74 /с
Эти фотоны находятся в пределах видимости 350 — 700 нм.
Пример 2
Моль фотонов называется эйнштейном. Сколько энергии в Дж составляет эйнштейн фотонов, описанных в примере 1.
Сколько энергии в Дж составляет эйнштейн фотонов, описанных в примере 1.
Решение
Энергия
1,6022e-19 Дж 6,022e23
3,2 эВ ————- — ————- = 308000 Дж = 308 кДж
1 эВ 1 фотон
ОБСУЖДЕНИЕ
Когда мы обсуждаем энергию Гиббса, мы узнали, что энтальпия образования для H 2 Оз — 285,83 кДж. Это означает, что нам нужно минимум 286 кДж для разложения воды. Таким образом, 1 эйнштейн фотонов имеет больше энергии для разложения моля воды, чем минимум. Однако для разложения воды требуется перенапряжение. Оксид титана смешивают с металлической платиной и оксидом рутения, чтобы облегчить образование пузырьков в этом процессе. (см. Неорганическая химия от Swaddle (стр. 125).
Вопросы
- В чем разница между физисорбцией и хемосорбцией?
Чтобы катализатор был эффективным, он должен сильно адсорбировать реагенты.
 Правда или ложь?
Правда или ложь? Что из следующего сильнее всего адсорбируется на поверхности никеля: кислород, метан, этен, окись углерода, азот?
Skill —
Приведите список химических веществ в порядке убывания их адсорбционной способности для переходных металлов.Какой из перечисленных металлов сильнее всего адсорбирует монооксид углерода на своей поверхности: Fe, Co, Ni, Rh, Ir
Навык —
Знать тенденцию адсорбционной прочности металлов по их положению в периодической таблице химических элементов.Для нестехиометрического соединения FeO 1,1 каково соотношение Fe 3+ / Fe 2+ по числу ионов?
Solutions
- Увеличение скорости достижения химического равновесия. Выборочно увеличивайте количество определенных продуктов. Разлагайте нежелательные продукты.

 Выхлопы выходят из трубы очень слабо;
Выхлопы выходят из трубы очень слабо;
 Правда или ложь?
Правда или ложь? 