Содержание
Маркировка гелевого аккумулятора: что означает маркировка?
Автор:
Сергей Куртов
Время прочтения: 5 мин
Дата публикации: 18-02-2022
Рейтинг статьи: (2129)
Содержание
Аккумуляторные батареи используются повсеместно и, возможно, являются наиболее востребованным в мире расходником. Так или иначе, периодически возникает потребность в новом аккумуляторе для замены уже израсходовавших ресурс батарей, либо для сборки источника питания для той или иной техники.
Выбор гелевого аккумулятора — задача непростая. Будет не совсем корректно подбирать модель лишь по емкости и напряжению, опустив другие факторы. Требуется полностью разобраться, какие технологии производства использовались в той или иной модели, и как эти технологии ведут себя в определенных ситуациях. Батарея должна подбираться не только исходя из потребностей пользователя, но и исходя из характеристик потребителя и режима его эксплуатации. По понятной причине многие в это не вникают: глупо изучать целую науку ради покупки гелевой аккумуляторной батареи. В такой ситуации наилучшим решением будет обратиться к специалисту, который подберет подходящую модель в зависимости от потребностей.
В такой ситуации наилучшим решением будет обратиться к специалисту, который подберет подходящую модель в зависимости от потребностей.
Маркировка гелевого аккумулятора может сказать о многом, поэтому опытному пользователю нет нужды искать характеристики в интернете — достаточно взглянуть на саму батарею.
Научиться разбирать маркировку, изучив пример пары-тройки аккумуляторов не получится, так как многие производители имеют свои особенности: от места расположения маркировок до их расшифровки. Поэтому мы рассмотрим лишь в общих чертах, что означает маркировка на гелевом аккумуляторе, чтобы было легче ориентироваться на разнообразном рынке свинцово-кислотных аккумуляторных батарей.
Читаем характеристики гелевого аккумулятора по маркировке
Сразу стоит уточнить, что маркировка тяговых гелевых аккумуляторов обычно сильно отличается от того, что пользователи привыкли видеть на рынке стартерных автомобильных АКБ. Также надо иметь в виду, что в разных странах используются разные маркировки, что значительно путает даже на фоне индивидуальных стандартов отдельных производителей. Тем не менее, основные данные на гелевых АКБ мало чем отличаются. Среди них выделим следующие:
Тем не менее, основные данные на гелевых АКБ мало чем отличаются. Среди них выделим следующие:
- Напряжение аккумулятора. Первым параметром, по которому следует фильтровать доступные аккумуляторные батареи — это напряжение. Стоит понимать, что значение, указанное на этикетке, не является точным параметром и уж точно не является напряжением, которым стоит заряжать. 6, 12, 24V — все это показатели напряжения при среднем уровне заряда без нагрузки. Хранить аккумуляторы с таким напряжением не стоит, лучше подзарядить.
- Емкость аккумулятора. Важнейший параметр, определяющий, как много энергии может накопить батарея. Емкость любого свинцового аккумулятора сильно зависит от степени нагрузки. Чем выше ток нагрузки, тем менее эффективна АКБ. Поэтому чаще всего емкость, указанная на этикетке, актуальна для 20-часового разряда. Иногда производитель явно указывает длительность разряда. К примеру, у Luxeon LX6-4.5 мы видим маркировку 6V4.5Ah30HR. Это значит, что данный 6-вольтовый аккумулятор выдает 4,5 ампер-часа при 20-часовом разряде.

- Тип аккумулятора. Понятие “гелевая аккумуляторная батарея” в народе используется не только для АКБ типа GEL, но и для аналогов AGM. Данные типы значительно отличаются по технико-эксплуатационным характеристикам, хотя их общий принцип довольно похож (абсорбирование электролита стекловолоконными прокладками или гелем). Также часто можно встретить аббревиатуру VRLA, что означает “свинцово-кислотный с регулировочными клапанами”.
- Напряжение заряда. Очень полезно, если производитель явно указывает оптимальное напряжение заряда. Как мы знаем, существует два основных режима работы гелевой АКБ: буферный и циклический. Буферный режим характерен для источников бесперебойного питания, когда аккумулятор практически все время поддерживается в заряженном состоянии. Циклический режим, в свою очередь, подразумевает регулярный сильный разряд с последующим полным зарядом. В зависимости от режима эксплуатации подбирается и напряжение заряда. Если оно не указано на этикетке, рекомендуется поискать мануалы в интернете.

- Ток заряда. Иногда, расшифровывая маркировку, можно увидеть и максимальный ток заряда. Эта информация не особо полезна, так как Вы не превысите максимальный ток, подав на клеммы гелевого аккумулятора напряжение, указанное как рекомендуемое для буферного/циклического режима.
- Стандарт и расположение клемм. Эти параметры важны, если Вы подбираете тяговый гелевый аккумулятор, опираясь на характеристики в интернете. В случае с маркировкой все иначе. Вряд ли Вам потребуются эти данные, когда аккумулятор находится в руках, а расположение и тип плюса и минуса прекрасно видны.
Когда был выпущен аккумулятор?
Дата выпуска аккумуляторной батареи очень важна как минимум из-за того, что старение начинается с самого начала химической реакции. Если аккумулятор продается не в сухом виде, то при длительном хранении на складе Вы рискуете приобрести уже немного изношенную АКБ.
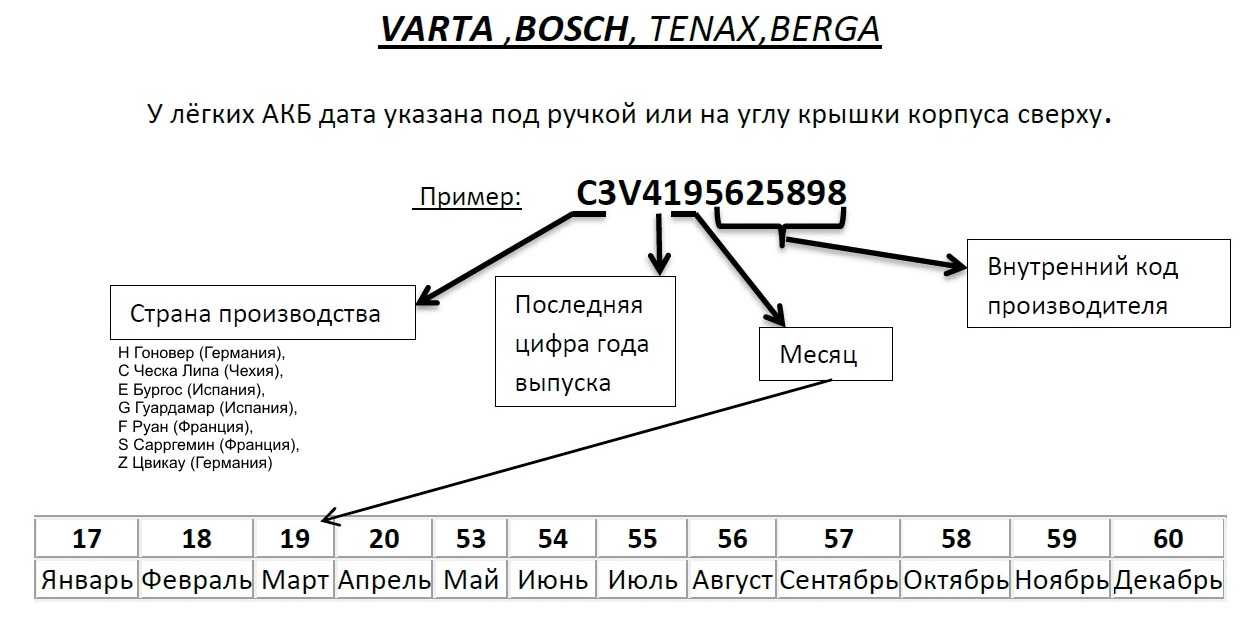
Чтобы купить аккумулятор с характеристиками, максимально близкими к заводским, требуется обратить внимание на дату выпуска батареи.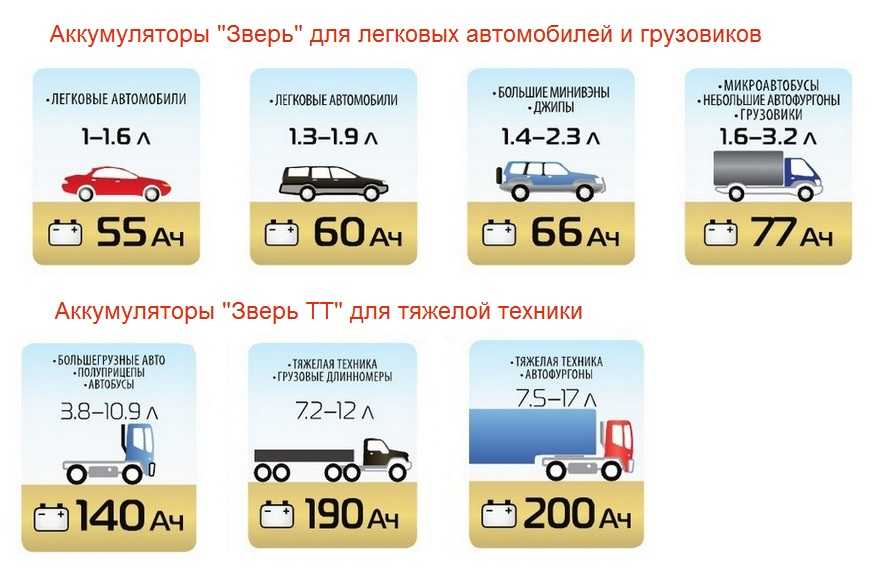 К сожалению, уникального способа расшифровать маркировку нет. Каждый производитель использует те или иные методы указания даты производства аккумулятора. Шифр обычно выбит непосредственно на пластике корпуса, либо наклеен на верхнем торце. Обычно это набор букв и цифр. При помощи данных в интернете Вы можете найти информацию о расшифровке маркировки конкретного производителя и узнать год и месяц выпуска аккумулятора. Иногда указывается даже день недели.
К сожалению, уникального способа расшифровать маркировку нет. Каждый производитель использует те или иные методы указания даты производства аккумулятора. Шифр обычно выбит непосредственно на пластике корпуса, либо наклеен на верхнем торце. Обычно это набор букв и цифр. При помощи данных в интернете Вы можете найти информацию о расшифровке маркировки конкретного производителя и узнать год и месяц выпуска аккумулятора. Иногда указывается даже день недели.
В качестве примера возьмем аккумуляторы BOSCH. Находим выбитую на верхнем торце маркировку и начинаем читать с четвертого символа. Так Вы узнаете год и месяц выпуска. Остальная информация (например, завод изготовителя) мало кого интересует.
Как итог, маркировка гелевого аккумулятора может многое сказать о характеристиках батареи, однако этого недостаточно ввиду большого количества нюансов и сильной зависимости эффективности от способа эксплуатации.
зарядка аккумулятора для автомобиля 12 В. Выбор зарядного устройства.
 Что это? Плюсы и минусы. Можно ли зарядить его обычной зарядкой?
Что это? Плюсы и минусы. Можно ли зарядить его обычной зарядкой?
-
Что это такое? -
Плюсы и минусы -
Популярные производители -
Как заряжать? -
Применение стандартного зарядного устройства -
Особенности эксплуатации
Параллельно с развитием автомобильной промышленности прогрессируют и технологии в изготовлении аккумуляторных батарей (АКБ). Сегодня автомашины оборудуются огромным количеством автоэлектроники: система «start/stop», электрические приводы, системы управления освещением, бортовые компьютеры и тому подобное.
Обыкновенным жидкостным аккумуляторным батареям нелегко справляться с подобным обилием энергопотребителей. На выручку приходит принципиально новая АКБ AGM, которая обладает усовершенствованными параметрами и характеристиками.
Что это такое?
AGM является технологией производства свинцово-кислотных АКБ, созданной инженерами корпорации Gates Rubber Company (США) в начале 70-х гг. прошлого столетия. Отличие аккумуляторов AGM от традиционных в том, что в них находится водный раствор серной кислоты в абсорбированном состоянии, а не в жидком, что дает ряд изменений в характеристиках аккумуляторной батареи.
Расшифровка аббревиатуры AGM – это Absorbed Glass Mat, что с английского языка переводится буквально как «абсорбирующая стеклонить» либо «абсорбирующий стеклянный мат». Это означает, что в корпусе отсутствует жидкий электролит, а взамен него используется пропитанная стеклонить.
Как и большинство иных новшеств, АКБ AGM поначалу практиковались в военной авиации.
Такие аккумуляторы наилучшим образом годились для них, поскольку могли использоваться в каком угодно положении. И до настоящего времени они эксплуатируются на истребителях F16.
В 90-х гг. концерн Concorde (Америка) изготовил первый AGM для использования в коммерческих целях. По ряду объективных факторов у них не получилось окончательно выдавить с рынка свинцово-кислотные аккумуляторы, которые обладали преимуществами, прежде всего в цене. Однако у AGM-аккумуляторов получилось найти собственный сегмент на автомобильном рынке премиум-класса, мототехники, киноаппаратуры, солнечных панелей и другого.
Плюсы и минусы
Необходимо сказать, что технология AGM в аккумуляторах далеко не безупречна, как и сами батареи. Потому-то одновременно с несомненными плюсами, они обладают и отдельными недостатками. Плюсы.
- Этот вид аккумуляторов не нуждается в обслуживании. А это означает, что уход за ними крайне минимален.
- Наделен большим стартерным током.
 Если сравнивать со свинцово-кислотным аккумулятором – он выше на 50-75%, что дорогого стоит при запуске зимой.
Если сравнивать со свинцово-кислотным аккумулятором – он выше на 50-75%, что дорогого стоит при запуске зимой. - Ему нестрашен «глубокий» разряд. Даже среднестатистическая АКБ AGM обязана справляться по меньшей мере с 200-и полными разрядками (в ноль), не меньше чем с 500-и разрядами аккумуляторов до 50% и с 1000-ю таких, что понижают емкость на 20-30%.
- Возможна эксплуатация и перевозка, в сущности, в каком угодно положении.
- Срок службы AGM – от 5 до 12 лет (если неукоснительно соблюдать правила подзарядки).
- Индифферентный к влиянию высоких температур внешней среды (к примеру, в пространстве под капотом автомобиля). Это делает его по классу выше всех традиционных и подавляющей массы гелевых источников питания.
Минусы:
- увеличенная масса;
- батарея AGM значительно дороже всех своих прототипов среди кислотно-свинцовых источников питания;
- требуются специализированные зарядные приборы;
- нуждается во внимании и предосторожности при подзарядке, а также при использовании на автомашинах, не оснащенных реле защиты от перезарядки.

Внимание! Технологию AGM в аккумуляторных батареях не следует принимать за панацею от всех мыслимых бед. Этот вид аккумуляторов очень чувствителен к перезарядке. Это означает, что, если автомашина не оборудована устройством, исключающим излишек заряда, – от приобретения подобных аккумуляторов следует отказаться.
Популярные производители
Аккумуляторы, произведенные в соответствии с технологией Absorbed Glass Mat, сегодня изготавливаются на многочисленных предприятиях во всем мире. В связи с этим, выбирая данную аккумуляторную батарею, необходимо тщательно изучить «подноготную» каждого из изготовителя. Стоимость аккумуляторной батареи AGM не дешевая, и за просчеты тоже придется платить по высокой цене. Мы рассмотрим 3-х лучших производителей и надеемся, что это даст возможность вам сделать правильный выбор при приобретении источника питания.
Одним из популярных брендов является EXIDE, который принадлежит компании EXIDE Technologies. Это структура, которая включает в себя собственный центр, занимающийся научными исследованиями, и не один десяток предприятий, разбросанных по всей планете – от Америки и стран Европы до Страны восходящего солнца. На долю данного гиганта приходится 5-я часть всего мирового рынка аккумуляторных батарей.
Это структура, которая включает в себя собственный центр, занимающийся научными исследованиями, и не один десяток предприятий, разбросанных по всей планете – от Америки и стран Европы до Страны восходящего солнца. На долю данного гиганта приходится 5-я часть всего мирового рынка аккумуляторных батарей.
Достоинства EXIDE:
- исторически сложившиеся традиции высокого качества – торговая марка известна с 1888 г;
- западные модели менеджмента – основной офис концерна располагается в Америке;
- свой центр, занимающийся научными исследованиями;
- долговременная гарантия на выпускаемую продукцию;
- обширный ассортимент автомобильных аккумуляторов и для мототехники всевозможной емкости.
Также источники питания по технологии Absorbed Glass Mat изготавливает известная корпорация из ФРГ BOSCH. Она является одной из старейших компаний Европы, начала изготовление аккумуляторных батарей больше века назад.
Корпорация BOSCH на сегодняшний день является международной структурой, которая включает в себя исследовательские, занимающиеся производством и дилерские отделения, дислоцированные по всему миру. Большое внимание руководителями компании уделяется сфере научных исследований. Так, только в предыдущем году концерном на проведение исследований было израсходовано свыше 4 млрд евро.
Положительные моменты BOSCH:
- одна из старейших компаний по производству аккумуляторных батарей – функционирует больше 100 лет;
- прогрессивные стандарты и концепции по управлению качеством;
- применение передовых технологических решений;
- модельный ряд аккумуляторных батарей, удовлетворяющий запросы всех потенциальных потребителей.
3-м кандидатом на звание лучшего изготовителя аккумуляторных батарей AGM является VARTA. АКБ для автомашин и мототехники под этой торговой маркой изготавливаются под наблюдением со стороны компании Johnson Controls (США).
АКБ для автомашин и мототехники под этой торговой маркой изготавливаются под наблюдением со стороны компании Johnson Controls (США).
Технологии очень сильно похожи на технологии BOSCH. В принципе, это лишь играет на руку продукции. Плюсы VARTA аналогичные остальным 2-м участвующим в нашем обзоре брендам. Это безукоризненное качество, обширный ассортимент и прочее.
Как заряжать?
Правильно подобранный способ и условия зарядки важны для безопасного использования АКБ и их разрядных характеристик. Не следует оставлять без внимания правила подзарядки AGM-аккамуляторов. На корпусе, как правило, указаны значения наименьшего и наибольшего напряжения при зарядке. Даже незначительное превышение способно спровоцировать непоправимые последствия для источника питания. В этой связи предпочтительнее практиковать специализированное зарядное приспособление с опцией настройки напряжения.
Перед зарядкой АКБ AGM необходимо ознакомиться с этапами этой процедуры:
- основной – емкость аккумулятора восстанавливается на 80%;
- плавающий – емкость источника питания восстанавливается до показателя в 100%;
- хранения – на этом этапе аккумуляторная батарея типа AGM использует минимум электротока от зарядного прибора;
- накопительный – источник питания приводит в норму и фиксирует свои рабочие характеристики.

Заряжать аккумуляторные батареи AGM требуется посредством специализированного прибора, который имеет модуль контроля заряда и способен определить напряжение и силу тока. Эти параметры непременно надо держать под контролем, иначе внутри аккумуляторной батареи может начаться нежелательный процесс образования газа. Запрещено заряжать аккумуляторы AGM посредством стандартных зарядных устройств. Для этой цели предпочтительнее использовать специальные станции со смарт-управлением (Smart power). Данные устройства дадут возможность заряжать AGM в щадящем режиме.
В процессе процедуры подзарядки следует держать под контролем температурные значения электролита. Они должны быть не больше +50°C, иначе технический ресурс автомобильного аккумулятора уменьшится.
Помимо этого, если для зарядки использовать напряжение более 15,2 В, то в батарее начнет происходить процесс гидролиза, который повлечет потерю воды из электролита и возникновение газовой подушки.
Это не наилучшим образом скажется на состоянии аккумулятора AGM.
Применение стандартного зарядного устройства
Зарядка AGM обычным зарядным электроприбором допускается лишь в режиме возмещения заряда от 75% до 100% значения (12,45 В). В случае «глубокого» разряда АКБ восстанавливаются исключительно посредством автоматических зарядных электроприборов. Целесообразно покупать модификации со смарт-управлением, которые предназначены для зарядки АКБ технологии Absorbed Glass Mat от разных изготовителей. Предпочтительными считаются устройства с интегрированной программой 3-ступенчатой зарядки на борту.
Предельное напряжение в ходе подзарядки не должно превосходить 14,8 В. Сила тока на каждой стадии разная и находится в зависимости от уровня разряженности аккумулятора, а также определенной технологии зарядки. Полная перезарядка требуется по достижении напряжения на клеммах 12,2 В.
Особенности эксплуатации
Чтобы аккумуляторная батарея прослужила продолжительное время, следует придерживаться некоторых обязательных принципов использования, зарядки и хранения батареи.
- Регулярно осуществляйте контроль над температурой АКБ, особенно при езде в жару. В АКБ AGM нет электролита в жидком виде. Как мы знаем, жидкость обладает большим коэффициентом передачи тепловой энергии, и потому обыкновенные свинцово-кислотные АКБ скорее отводят тепло, хотя порой и кипят. AGM почти не кипит, но и тепло отводит похуже. От перегрева способны и пластины поплыть. По максимуму освободите AGM для естественного вентилирования.
- Не допускайте запуска мотора длительностью больше 15 с., совершайте паузы между неудачными пусками больше 30 с.
- Следите за чистотой клемм и надежностью соединения, удаляйте с них влагу и загрязнения, поскольку это увеличивает саморазряд.
- Использовать и хранить аккумулятор можно, в сущности, в каком угодно положении. При хранении его надо регулярно подвергать проверке и подзаряжать при потребности. AGM могут сохраняться очень долго без существенного снижения емкости. За 12 месяцев (при температуре воздуха 5-15°C) они лишаются примерно 15-20% заряда.

Аккумулятор AGM прекрасно выдерживает отрицательные температуры зимой. Однако крепкие морозы также вредны и понижают продуктивность.
Неопределенности в оценке потока пентозофосфатного пути недооценивают его вклад в потребление нейронами глюкозы: значимость для нейродегенерации и старения
Влияние ПФП на окислительно-восстановительный потенциал и сохранение энергии 6-фосфат (G6P) в две последовательные стадии, катализируемые глюкозо-6-фосфатдегидрогеназой (G6PD) и 6-фосфоглюконатдегидрогеназой (6PGD), с образованием рибулозо-5-фосфата (Ru5P) (рис. 1) (Wamelink et al., 2008). Эти этапы составляют так называемую окислительную ветвь PPP, где окислительно-восстановительная энергия G6P сохраняется в виде NADPH(H
+ ). Вместе с другими регенерирующими системами NADPH(H + ), такими как NADP-зависимая изоцитратдегидрогеназа и яблочный фермент (ME), окислительная ветвь PPP представляет собой наиболее важный источник восстанавливающих эквивалентов для (i) антиоксидантных ферментов, таких как глутатионпероксидазы. и тиоредоксинредуктазы и (ii) синтазу жирных кислот (Dringen et al., 2007). Ru5P изомеризуется в рибозо-5-фосфат (R5P), который служит либо предшественником для биосинтеза нуклеотидов, либо продолжает метаболизм через неокислительную ветвь PPP. В последнем R5P эпимеризуется в ксилулозо-5-фосфат (Xu5P), с которым он транскетолазирует, продуцируя седогептулозо-7-фосфат (S7P) плюс глицеральдегид-3-фосфат (G3P). В свою очередь, трансальдолаза S7P и G3P образует фруктозо-6-фосфат (F6P) и эритрозо-4-фосфат (E4P). Затем E4P транскетолируется с Xu5P, образуя F6P и G3P. Таким образом, через PPP три моля G6P дают три CO 2 , два F6P и один G3P. Поскольку F6P и G3P, полученные из PPP, также являются промежуточными продуктами гликолиза, они могут следовать за превращением в пируват. Таким образом, гликолиз и PPP представляют собой два разных пути, которые имеют общие пулы промежуточных продуктов F6P и G3P. Соответственно, G6P, преобразованный в пируват через PPP, сохраняет как окислительно-восстановительные, так и энергетические значения глюкозы, подчеркивая еще не распознанное высокое влияние активности потока PPP на окислительно-восстановительную/сохранение энергии.
и тиоредоксинредуктазы и (ii) синтазу жирных кислот (Dringen et al., 2007). Ru5P изомеризуется в рибозо-5-фосфат (R5P), который служит либо предшественником для биосинтеза нуклеотидов, либо продолжает метаболизм через неокислительную ветвь PPP. В последнем R5P эпимеризуется в ксилулозо-5-фосфат (Xu5P), с которым он транскетолазирует, продуцируя седогептулозо-7-фосфат (S7P) плюс глицеральдегид-3-фосфат (G3P). В свою очередь, трансальдолаза S7P и G3P образует фруктозо-6-фосфат (F6P) и эритрозо-4-фосфат (E4P). Затем E4P транскетолируется с Xu5P, образуя F6P и G3P. Таким образом, через PPP три моля G6P дают три CO 2 , два F6P и один G3P. Поскольку F6P и G3P, полученные из PPP, также являются промежуточными продуктами гликолиза, они могут следовать за превращением в пируват. Таким образом, гликолиз и PPP представляют собой два разных пути, которые имеют общие пулы промежуточных продуктов F6P и G3P. Соответственно, G6P, преобразованный в пируват через PPP, сохраняет как окислительно-восстановительные, так и энергетические значения глюкозы, подчеркивая еще не распознанное высокое влияние активности потока PPP на окислительно-восстановительную/сохранение энергии.
Рис. 1. 13 Схема мечения C-пирувата из [2- 13 C]глюкозы путем рециркуляции PPP недооценивает вклад PPP в метаболизм глюкозы . Образец маркировки 13 C-пирувата, полученного в результате гликолиза ([2- 13 C]пируват), отличается от такового, полученного в результате первого раунда PPP ([3- 13 C]- и [1,3- 13 C 2 ]пируват), что помогает оценить вклад обоих путей в утилизацию глюкозы (синий углерод). Однако некоторые типы клеток, такие как нейроны, проявляют высокую активность PGI, ответственную за высокую скорость уравновешивания F6P с G6P, что приводит к , перерабатывающий -подобный ППС (ППП – второй и третий раунды). Идентификация этих рециклируемых промежуточных продуктов, меченных 13 C (черный углерод), позволяет выявить более сложную схему маркировки 13 C-пирувата ([1- 13 C]-, [2- 13 C]- и [1,2- 13 C 2 ]пируват после второго раунда PPP; схема после третьего раунда PPP опущена для простоты), что переоценивает гликолиз и, следовательно, недооценивает вклад PPP в утилизацию глюкозы. Обратите внимание, что [1- 13 С]пируват также может поступать из цикла ТСА (пируват рециклинг ; см. текст). Тем не менее, это образование составляет всего одну двенадцатую часть пирувата, полученного во втором цикле PPP, что, вероятно, минимально влияет на оценку активности PPP. Поэтому маркировка в 13 C-Ru5P и 13 C-R5P ([2- 13 C]-, [1,2- 13 C 2 ]-, [1,2,3- 13 C 3 ]- и т. д.) после второго раунда PPP можно использовать для точной оценки PPP в ячейках с высокой степенью рециркуляции.
Обратите внимание, что [1- 13 С]пируват также может поступать из цикла ТСА (пируват рециклинг ; см. текст). Тем не менее, это образование составляет всего одну двенадцатую часть пирувата, полученного во втором цикле PPP, что, вероятно, минимально влияет на оценку активности PPP. Поэтому маркировка в 13 C-Ru5P и 13 C-R5P ([2- 13 C]-, [1,2- 13 C 2 ]-, [1,2,3- 13 C 3 ]- и т. д.) после второго раунда PPP можно использовать для точной оценки PPP в ячейках с высокой степенью рециркуляции.
Оценка радиоактивного PPP Ex Vivo
Несколько подходов использовались для оценки доли G6P, которая метаболизируется через PPP. Для проведенных экспериментов ex vivo (культивированные и свежевыделенные клетки или срезы тканей), радиометрическое 14 CO 2 обнаружение после инкубации биологических образцов в присутствии [1- 14 C]глюкозы при исходных скоростные условия, сообщает поток через окислительную ветвь ППС. Однако, поскольку C 1 -G6P также декарбоксилируется в цикле трикарбоновых кислот (TCA), значение 14 CO 2 , взятое само по себе, по существу завышает активность PPP. Чтобы преодолеть этот недостаток, необходимо провести параллельную инкубацию в идентичных условиях для количественного определения 14 CO 2 , собранных из [6- 14 C]глюкозы, поскольку C 6 -G6P декарбоксилируется исключительно в TCA после G6P превращается в пируват как посредством гликолиза, так и посредством PPP. Таким образом, разница в скорости 14 CO 2 производится из [1- 14 C]глюкозы, а из [6- 14 C]глюкозы представляет собой поток 14 CO 2 , производимый исключительно в окислительном отделении PPP (Hothersall) и др., 1979; Ларраби, 1989). Хотя этот подход подходит для анализов ex vivo , он технически утомителен для оценок in vivo PPP, поскольку CO 2 collection in vivo едва ли можно назвать количественным.
Однако, поскольку C 1 -G6P также декарбоксилируется в цикле трикарбоновых кислот (TCA), значение 14 CO 2 , взятое само по себе, по существу завышает активность PPP. Чтобы преодолеть этот недостаток, необходимо провести параллельную инкубацию в идентичных условиях для количественного определения 14 CO 2 , собранных из [6- 14 C]глюкозы, поскольку C 6 -G6P декарбоксилируется исключительно в TCA после G6P превращается в пируват как посредством гликолиза, так и посредством PPP. Таким образом, разница в скорости 14 CO 2 производится из [1- 14 C]глюкозы, а из [6- 14 C]глюкозы представляет собой поток 14 CO 2 , производимый исключительно в окислительном отделении PPP (Hothersall) и др., 1979; Ларраби, 1989). Хотя этот подход подходит для анализов ex vivo , он технически утомителен для оценок in vivo PPP, поскольку CO 2 collection in vivo едва ли можно назвать количественным.
13 C-NMR PPP Assessment In Vivo
Несколько подходов использовались для оценки доли G6P, которая метаболизируется через PPP in vivo , которые также применимы для ex vivo . Широко используемый метод основан на анализе содержания определенных атомов углерода в лактате при перфузии ( in vivo ) или инкубации ( ex vivo ) с [2- 13 C]глюкозой. Таким образом, обилие [3- 13 9Предполагается, что 0006 C] лактат образуется исключительно посредством метаболизма PPP, тогда как обилие [2- 13 C] лактата, , гликолиза (рис. 1) (Brekke et al., 2012). При немного другом подходе, основанном на использовании [1,2- 13 C 2 ]глюкозы, содержание [3- 13 C]лактата и [2,3- 13 C]лактата равно Считается, что он возник посредством PPP и гликолиза, соответственно (Jalloh et al., 2015). [1,6- 13 C 2 ,6,6- 2 H 2 ] глюкоза также использовалась для измерения церебральной активности PPP in vivo (Ben-Yoseph et al. , 1995) на основании того, что она производит [3- 13 C]лактат и [3- 13 C,3,3- 2 H 2 ]лактат посредством гликолиза, но [3- 13 C,3,3- 2 H 2 ]лактат и немеченый лактат через PPP (Ross et al., 1994). Соотношения этих изотопомеров лактата могут быть определены количественно с помощью газовой хроматографии/масс-спектрометрии для расчета активности PPP и выражены в виде процента глюкозы, метаболизирующейся в лактат, который прошел через PPP (Ross et al., 19).94; Бен-Йосеф и др., 1995). Эти анализы предоставляют информацию об относительном вкладе метаболического пути в общую утилизацию глюкозы, в отличие от анализов начальной скорости, которые информируют об абсолютных значениях метаболического потока. Хотя такая разница может объяснить разногласия в значениях активности PPP, о которых сообщают разные лаборатории (Herrero-Mendez et al., 2009; Brekke et al., 2012; Rodriguez-Rodriguez et al., 2013), по нашему мнению, есть некоторые методологические проблемы, как объяснено ниже.
, 1995) на основании того, что она производит [3- 13 C]лактат и [3- 13 C,3,3- 2 H 2 ]лактат посредством гликолиза, но [3- 13 C,3,3- 2 H 2 ]лактат и немеченый лактат через PPP (Ross et al., 1994). Соотношения этих изотопомеров лактата могут быть определены количественно с помощью газовой хроматографии/масс-спектрометрии для расчета активности PPP и выражены в виде процента глюкозы, метаболизирующейся в лактат, который прошел через PPP (Ross et al., 19).94; Бен-Йосеф и др., 1995). Эти анализы предоставляют информацию об относительном вкладе метаболического пути в общую утилизацию глюкозы, в отличие от анализов начальной скорости, которые информируют об абсолютных значениях метаболического потока. Хотя такая разница может объяснить разногласия в значениях активности PPP, о которых сообщают разные лаборатории (Herrero-Mendez et al., 2009; Brekke et al., 2012; Rodriguez-Rodriguez et al., 2013), по нашему мнению, есть некоторые методологические проблемы, как объяснено ниже.
Возникновение повторного использования PPP
Критический момент, который часто упускается из виду, — это возникновение повторного использования G6P из F6P, полученного из PPP. Таким образом, фосфоглюкозоизомераза (PGI) представляет собой почти равновесный фермент, который, как было показано, проявляет высокую активность при превращении F6P в G6P в определенных клетках и/или тканях, таких как, например, нейроны (Gaitonde et al., 1989), которые может повторно войти в PPP (рис. 1). В такой рециклинге -подобного PPP только G3P, полученный из PPP, полностью ускользает из этого цикла и превращается в пируват посредством гликолиза. Высокое извлечение G6P из F6P, полученного из PPP, может представлять собой биоэнергетическое преимущество, поскольку окислительно-восстановительная энергия глюкозы может сохраняться в виде NADPH(H + ) за счет только одного углерода (C 1 ) на G6P. Следует отметить, что в некоторых клетках, таких как нейроны, узким местом гликолиза является 6-фосфофрукто-1-киназа (PFK1, которая превращает F6P в фруктозо-1,6-бифосфат или F16BP) (Almeida et al. , 2004). Таким образом, активность PFK1 in situ очень низка в нейронах по сравнению, например, с соседними астроцитами (Almeida et al., 2004). Такая низкая активность PFK1 обусловлена фактическим отсутствием 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы-3 (PFKFB3) (Herrero-Mendez et al., 2009).), ответственный за образование фруктозо-2,6-бисфосфата (F26BP) — наиболее мощного положительного эффектора PFK1. Напротив, астроциты обильно экспрессируют белок PFKFB3 и концентрацию F26BP и, соответственно, высокую активность in situ PFK1 (Almeida et al., 2004). Поэтому вполне вероятно, что, хотя F6P, полученный из PPP, преимущественно рециркулируется в PPP в нейронах, он предпочтительно превращается в лактат в астроцитах. На самом деле, активность in situ PFK1 примерно в четыре раза ниже в нейронах по сравнению с астроцитами (Almeida et al., 2004). Следовательно, мы предполагаем, что в нейронах (i) большая часть F6P, полученного из PPP, рециркулируется обратно в PPP, и (ii) подавляющее большинство пула G3P возникает непосредственно в результате активности PPP.
, 2004). Таким образом, активность PFK1 in situ очень низка в нейронах по сравнению, например, с соседними астроцитами (Almeida et al., 2004). Такая низкая активность PFK1 обусловлена фактическим отсутствием 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы-3 (PFKFB3) (Herrero-Mendez et al., 2009).), ответственный за образование фруктозо-2,6-бисфосфата (F26BP) — наиболее мощного положительного эффектора PFK1. Напротив, астроциты обильно экспрессируют белок PFKFB3 и концентрацию F26BP и, соответственно, высокую активность in situ PFK1 (Almeida et al., 2004). Поэтому вполне вероятно, что, хотя F6P, полученный из PPP, преимущественно рециркулируется в PPP в нейронах, он предпочтительно превращается в лактат в астроцитах. На самом деле, активность in situ PFK1 примерно в четыре раза ниже в нейронах по сравнению с астроцитами (Almeida et al., 2004). Следовательно, мы предполагаем, что в нейронах (i) большая часть F6P, полученного из PPP, рециркулируется обратно в PPP, и (ii) подавляющее большинство пула G3P возникает непосредственно в результате активности PPP. Однако в астроцитах пул G3P образуется из (i) G6P посредством гликолиза, (ii) F6P, полученного из PPP, затем посредством гликолиза и (iii) непосредственно из активности PPP. По нашему мнению, эти соображения могут иметь значение при интерпретации данных 13 C-маркировки для оценки активности PPP, как указано ниже.
Однако в астроцитах пул G3P образуется из (i) G6P посредством гликолиза, (ii) F6P, полученного из PPP, затем посредством гликолиза и (iii) непосредственно из активности PPP. По нашему мнению, эти соображения могут иметь значение при интерпретации данных 13 C-маркировки для оценки активности PPP, как указано ниже.
Оценка ППС существенно занижена
При использовании [2- 13 C]глюкозы для инфузии и/или инкубации [1- 13 C]- и [1,3- 13 C
2 0] содержание лактата зависит исключительно от ППС, тогда как [2- 13 Обилие C] лактата зависит от гликолиза (рис. 1). Поэтому относительное количество [1- 13 C]- и [1,3- 13 C 2 ]лактата по сравнению с общим лактатом часто считается долей глюкозы, метаболизируемой через PPP (Brekke и др., 2012). Однако [1,3- 13 C 2 ]F6P, образующийся в ПФП из [2- 13 C]глюкозы, при превращении в [1,3- 13 C 2 ]G6P через активность PGI (формирование F6P → G6P), которая очень высока в нейронах (Gaitonde et al. , 1989), может производить [2- 13 C]F6P во втором раунде PPP (рис. 1). Таким образом, начиная со второго раунда PPP и далее, такой [2- 13 C]F6P также будет давать [2- 13 C]лактат, в значительной степени переоценивая гликолиз. Кроме того, при измерении [3- 13 C,3,3- 2 H 2 ]лактата плюс немеченого лактата, который образуется из [1,6- 13 С 2 ,6,6- 2 Н 2 ]глюкозы (Ben-Yoseph et al., 1995), поскольку этот подход не учитывает долю и скорость, с которой F6P рециркулируется обратно в PPP. Таким образом, можно сделать вывод, что методологические подходы к оценке активности рециркуляции PPP могут быть изначально недооценены в нейронах. Мы предполагаем, что степень рециркуляции активности PPP лучше всего определяется уровнями специфичных для PPP промежуточных продуктов (рис. 1). Ввиду того, что [1,2- 13 C 2 ]Ru5P образуется исключительно при переработке ПФП из [2- 13 C]глюкоза при входе в третий раунд и [1,2,3- 13 C 3 ]Ru5P при входе в четвертый раунд мы предлагаем определить относительное содержание мономеченых по сравнению с множественными мечеными 13 C-R5P + 13 C-Ru5P, что возможно с помощью жидкостной хроматографии/масс-спектроскопии (ЖХ/МС).
, 1989), может производить [2- 13 C]F6P во втором раунде PPP (рис. 1). Таким образом, начиная со второго раунда PPP и далее, такой [2- 13 C]F6P также будет давать [2- 13 C]лактат, в значительной степени переоценивая гликолиз. Кроме того, при измерении [3- 13 C,3,3- 2 H 2 ]лактата плюс немеченого лактата, который образуется из [1,6- 13 С 2 ,6,6- 2 Н 2 ]глюкозы (Ben-Yoseph et al., 1995), поскольку этот подход не учитывает долю и скорость, с которой F6P рециркулируется обратно в PPP. Таким образом, можно сделать вывод, что методологические подходы к оценке активности рециркуляции PPP могут быть изначально недооценены в нейронах. Мы предполагаем, что степень рециркуляции активности PPP лучше всего определяется уровнями специфичных для PPP промежуточных продуктов (рис. 1). Ввиду того, что [1,2- 13 C 2 ]Ru5P образуется исключительно при переработке ПФП из [2- 13 C]глюкоза при входе в третий раунд и [1,2,3- 13 C 3 ]Ru5P при входе в четвертый раунд мы предлагаем определить относительное содержание мономеченых по сравнению с множественными мечеными 13 C-R5P + 13 C-Ru5P, что возможно с помощью жидкостной хроматографии/масс-спектроскопии (ЖХ/МС).
Завышение гликолиза
Общепринято определять общий лактат, высвобождаемый из клеток, как показатель гликолиза. Однако, учитывая, что, по крайней мере, при некоторых обстоятельствах, точная пропорция G6P, которая метаболизируется через PPP в лактат, неизвестна, общий лактат как показатель гликолиза следует принимать с осторожностью. Мы скорее предлагаем рассматривать высвобождение лактата как общий показатель утилизации глюкозы, то есть гликолиз плюс ППС. Для оценки гликолиза используют [5-9Превращение 0005 3 Н]глюкозы в 3 Н 2 О, происходящее на енолазе, часто используется для оценки скорости гликолиза (Neely et al., 1972). Однако, поскольку енолаза не может различить происхождение — гликолиз или РРР — своего субстрата — 2-фосфоглицерата, образование 3 Н 2 О из [5- 3 Н]глюкозы не помогает прояснить специфические Участие гликолиза в утилизации глюкозы. Таким образом, использование [5- 3 H]глюкозы может сильно завысить скорость гликолиза в нейронах, как это было показано в сердце крысы (Goodwin et al. , 2001), что, в свою очередь, занижает ППС. Мы рекомендуем использовать [3- 3 H]глюкоза для оценки гликолиза, поскольку 3 H C 3 -глюкоза взаимозаменяется с водой на альдолазу (Katz et al., 1965), что снижает вклад PPP в собранный 3 H 2 O. Поскольку активность PFK1 in situ в нейронах очень низка (Herrero-Mendez et al., 2009), подход [3- 3 H]глюкозы более точно отражает гликолиз, чем [5- 3 H] глюкоза один. Используя [3- 3 H]глюкозу, мы сообщили, что первичные нейроны коры продуцируют 3 H 2 O со скоростью, которая примерно в четыре раза ниже, чем в первичных кортикальных астроцитах (Almeida et al., 2004). Однако доля глюкозы, которая метаболизируется посредством гликолиза в нейронах, может быть завышена. Широко сообщалось, что перфузия [1- 13 C]глюкозы у грызунов вызывает в головном мозге более высокое 13 C-специфическое обогащение [4- 13 C]глутаматом (в основном присутствующим в нейронах) по сравнению с до [4- 13 C]глутамина (в основном присутствует в астроцитах) (Fitzpatrick et al.
, 2001), что, в свою очередь, занижает ППС. Мы рекомендуем использовать [3- 3 H]глюкоза для оценки гликолиза, поскольку 3 H C 3 -глюкоза взаимозаменяется с водой на альдолазу (Katz et al., 1965), что снижает вклад PPP в собранный 3 H 2 O. Поскольку активность PFK1 in situ в нейронах очень низка (Herrero-Mendez et al., 2009), подход [3- 3 H]глюкозы более точно отражает гликолиз, чем [5- 3 H] глюкоза один. Используя [3- 3 H]глюкозу, мы сообщили, что первичные нейроны коры продуцируют 3 H 2 O со скоростью, которая примерно в четыре раза ниже, чем в первичных кортикальных астроцитах (Almeida et al., 2004). Однако доля глюкозы, которая метаболизируется посредством гликолиза в нейронах, может быть завышена. Широко сообщалось, что перфузия [1- 13 C]глюкозы у грызунов вызывает в головном мозге более высокое 13 C-специфическое обогащение [4- 13 C]глутаматом (в основном присутствующим в нейронах) по сравнению с до [4- 13 C]глутамина (в основном присутствует в астроцитах) (Fitzpatrick et al. , 1990; Канамацу и Цукада, 1994 г.; Бузиер и др., 1999). При сравнении специфического обогащения [4- 13 C]глутамата и [1- 13 C]глюкозы было подсчитано, что ~90% [4- 13 C]глутамата образовалось в результате гликолитического метаболизма. [1- 13 С]глюкозы. Потеря ~10% удельного обогащения [4- 13 C]глутамата обычно объясняется потерей 13 C 1 в ППС. К сожалению, эта интерпретация не учитывает, что [3- 13 C]лактат может активно использоваться нейронами и превращаться в [4- 13 C]глутамат in vivo (Bouzier et al., 2000), поскольку гликолитически генерируемый лактат перемещается из астроцитов в нейроны (Pellerin и Magistretti, 1994; Bouzier-Sore et al., 2006), таким образом недооценивая in vivo нейронных PPP.
, 1990; Канамацу и Цукада, 1994 г.; Бузиер и др., 1999). При сравнении специфического обогащения [4- 13 C]глутамата и [1- 13 C]глюкозы было подсчитано, что ~90% [4- 13 C]глутамата образовалось в результате гликолитического метаболизма. [1- 13 С]глюкозы. Потеря ~10% удельного обогащения [4- 13 C]глутамата обычно объясняется потерей 13 C 1 в ППС. К сожалению, эта интерпретация не учитывает, что [3- 13 C]лактат может активно использоваться нейронами и превращаться в [4- 13 C]глутамат in vivo (Bouzier et al., 2000), поскольку гликолитически генерируемый лактат перемещается из астроцитов в нейроны (Pellerin и Magistretti, 1994; Bouzier-Sore et al., 2006), таким образом недооценивая in vivo нейронных PPP.
Повторное использование пирувата
Пируват может быть регенерирован из промежуточных продуктов цикла ТСА малата и оксалоацетата посредством ME и PEPCK соответственно. Такой пируват 9Было показано, что рециклинг 0018 происходит в нейронах (Cerdan et al., 1990; Cruz et al., 1998), где яблочный фермент экспрессируется обильно (Vogel et al., 1998; McKenna et al., 2000), хотя также предполагалось его появление в астроцитах (Olstad et al., 2007). Таким образом, при использовании [2- 13 C]глюкозы для оценки активности PPP [2- 13 C]пируват, поступающий в цикл ТСА, будет давать [1- 13 C]пируват из повторного использования , который будет неотличим от возвращенного из второго раунда PPP (рис. 1). Это еще больше подкрепляет наше предложение о том, что ППС следует оценивать путем измерения 13 C включение в сахар с пятью атомами углерода, а не в лактат или пируват.
Такой пируват 9Было показано, что рециклинг 0018 происходит в нейронах (Cerdan et al., 1990; Cruz et al., 1998), где яблочный фермент экспрессируется обильно (Vogel et al., 1998; McKenna et al., 2000), хотя также предполагалось его появление в астроцитах (Olstad et al., 2007). Таким образом, при использовании [2- 13 C]глюкозы для оценки активности PPP [2- 13 C]пируват, поступающий в цикл ТСА, будет давать [1- 13 C]пируват из повторного использования , который будет неотличим от возвращенного из второго раунда PPP (рис. 1). Это еще больше подкрепляет наше предложение о том, что ППС следует оценивать путем измерения 13 C включение в сахар с пятью атомами углерода, а не в лактат или пируват.
PPP является преимуществом для нейронов, которые могут дать сбой при нейродегенерации и старении их выживание. Поскольку NADPH(H
+ ) необходим для этого процесса, рециклирующая версия PPP, которая восстанавливает значительную часть G6P, объясняет как низкое потребление глюкозы, так и эффективную активность нейронов по регенерации GSH. Напротив, астроциты экспрессируют более высокую степень ограничения скорости PPP G6PD и активность PPP, чем нейроны (Garcia-Nogales et al., 2003; Herrero-Mendez et al., 2009).), помимо более высокого уровня гликолиза (Almeida et al., 2004; Herrero-Mendez et al., 2009). Это, вероятно, указывает на то, что как нерециркулирующий PPP, так и гликолиз способствуют потреблению глюкозы астроцитами. Соответственно, восстановление G6P за счет повторного использования PPP в нейронах представляет собой преимущество для выживания нейронов. В настоящее время исследования ПЭТ показывают большое количество доказательств снижения потребления глюкозы — фактически отражающего поглощение глюкозы — в человеческом мозге во время старения и нейродегенерации (Chen and Zhong, 2013). Это наблюдение было широко интерпретировано как предполагаемая причина ограниченного производства энергии в нейронах. Однако до того, как мы раскроем реальный вклад ППС в потребление глюкозы клетками мозга, особенно нейронами и астроцитами, такое утверждение остается неопределенным.
Напротив, астроциты экспрессируют более высокую степень ограничения скорости PPP G6PD и активность PPP, чем нейроны (Garcia-Nogales et al., 2003; Herrero-Mendez et al., 2009).), помимо более высокого уровня гликолиза (Almeida et al., 2004; Herrero-Mendez et al., 2009). Это, вероятно, указывает на то, что как нерециркулирующий PPP, так и гликолиз способствуют потреблению глюкозы астроцитами. Соответственно, восстановление G6P за счет повторного использования PPP в нейронах представляет собой преимущество для выживания нейронов. В настоящее время исследования ПЭТ показывают большое количество доказательств снижения потребления глюкозы — фактически отражающего поглощение глюкозы — в человеческом мозге во время старения и нейродегенерации (Chen and Zhong, 2013). Это наблюдение было широко интерпретировано как предполагаемая причина ограниченного производства энергии в нейронах. Однако до того, как мы раскроем реальный вклад ППС в потребление глюкозы клетками мозга, особенно нейронами и астроцитами, такое утверждение остается неопределенным. Мы здесь полагаем, что снижение утилизации глюкозы, происходящее при старении и нейродегенерации, далеко не просто вызывает биоэнергетическую проблему, а может быть ответственно за окислительное повреждение из-за неспособности NADPH(H 9 ), полученного из PPP.0005 + ) регенерация в нейронах. Кроме того, мы также предполагаем, что нарушение утилизации глюкозы, наблюдаемое в исследованиях ПЭТ при нейродегенерации и старении, отражает, главным образом, снижение потребления глюкозы астроцитами. Это, в свою очередь, приведет к уменьшению высвобождения лактата для преобразования нейронов либо в энергию, либо в нейротрансмиттер глутамат. Любая гипотеза, то есть низкая активность PPP нейронов, вызывающая нарушение антиоксидантной способности, низкое снабжение лактата астроцитами или их комбинация, могла быть в значительной степени упущена из виду как причина как биоэнергетического, так и антиоксидантного повреждения нейронов при старении и нейродегенерации. Необходимо провести более глубокие исследования для преодоления отмеченных здесь методологических недостатков, чтобы выявить фактический вклад PPP в выживаемость нейронов in vivo .
Мы здесь полагаем, что снижение утилизации глюкозы, происходящее при старении и нейродегенерации, далеко не просто вызывает биоэнергетическую проблему, а может быть ответственно за окислительное повреждение из-за неспособности NADPH(H 9 ), полученного из PPP.0005 + ) регенерация в нейронах. Кроме того, мы также предполагаем, что нарушение утилизации глюкозы, наблюдаемое в исследованиях ПЭТ при нейродегенерации и старении, отражает, главным образом, снижение потребления глюкозы астроцитами. Это, в свою очередь, приведет к уменьшению высвобождения лактата для преобразования нейронов либо в энергию, либо в нейротрансмиттер глутамат. Любая гипотеза, то есть низкая активность PPP нейронов, вызывающая нарушение антиоксидантной способности, низкое снабжение лактата астроцитами или их комбинация, могла быть в значительной степени упущена из виду как причина как биоэнергетического, так и антиоксидантного повреждения нейронов при старении и нейродегенерации. Необходимо провести более глубокие исследования для преодоления отмеченных здесь методологических недостатков, чтобы выявить фактический вклад PPP в выживаемость нейронов in vivo .
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Это исследование получило финансовую поддержку французского государства в рамках программы «Инвестиции в будущее» IdEx и Labex (TRAIL) Бордо, ссылки ANR-10-IDEX-03-02 и ANR-10- ЛАБХ-57. JB финансируется MINECO (SAF2013-41177-R), ISCIII (RD12/0043/0021), EU-ITN (608381), NIH/NIDA (1R21DA037678-01), MECD (Государственная программа продвижения талантов и внедрения I+D+i, PRX14/00387) и Европейский фонд регионального развития.
Сокращения
E4P, эритрозо-4-фосфат; F6P, фруктозо-6-фосфат; F6B, фруктозо-1,6-бисфосфат; G3P, глицеральдегид-3-фосфат; G6P, глюкозо-6-фосфат; R5P, рибозо-5-фосфат; G6PD, глюкозо-6-фосфатдегидрогеназа; GSH, глутатион, восстановленная форма; GSSG, глутатион, окисленная форма; F26BP, фруктозо-2,6-бисфосфат; МЭ, яблочный фермент; PEPCK, фосфоенолпируваткарбоксикиназа; PFK1, 6-фосфофрукто-1-киназа; PFKFB3, 6-фосфофрукто-2-киназа/фруктозо-2,6-бисфосфатаза, изоформа 3; PGI, фосфоглюкозоизомераза; 6PGD, 6-фосфоглюконатдегидрогеназа; PPP, пентозофосфатный путь; Ru5P, рибулозо-5-фосфат; TCA, трикарбоновая кислота; S7P, седогептулозо-7-фосфат; Xu5P, ксилулозо-5-фосфат.
Ссылки
Алмейда, А., Монкада, С., и Боланьос, Дж. П. (2004). Оксид азота включает гликолиз посредством протеинкиназы AMP и пути 6-фосфофрукто-2-киназы. Нац. Клеточный Биол . 6, 45–51. doi: 10.1038/ncb1080
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Бен-Йосеф О., Кэмп Д.М., Робинсон Т.Е. и Росс Б.Д. (1995). Динамические измерения активности церебрального пентозофосфатного пути in vivo с использованием [1,6- 13 C 2 ,6,6- 2 H 2 ]глюкоза и микродиализ. Дж. Нейрохим . 64, 1336–1342.
Реферат PubMed | Google Scholar
Боланьос Дж. П., Хилс С. Дж., Пеухен С., Баркер Дж. Э., Лэнд Дж. М. и Кларк Дж. Б. (1995). Опосредованное оксидом азота повреждение митохондрий: потенциальная нейропротекторная роль глутатиона. Свободный радикал. биол. Мед . 21, 995–1001.
Реферат PubMed | Google Scholar
Бузье А.К., Кессон Б., Вален Х. , Каниони П. и Мерль М. (1999). [1- 13 C] метаболизм глюкозы в опухолевой и неопухолевой ткани головного мозга крысы с глиомой. Дж. Нейрохим . 72, 2445–2455.
, Каниони П. и Мерль М. (1999). [1- 13 C] метаболизм глюкозы в опухолевой и неопухолевой ткани головного мозга крысы с глиомой. Дж. Нейрохим . 72, 2445–2455.
Реферат PubMed | Google Scholar
Бузье А.К., Тиодьер Э., Биран М., Роуланд Р., Каниони П. и Мерль М. (2000). Метаболизм [3- 13 C] лактата в мозге крыс характерен для компартмента, лишенного пируваткарбоксилазы. Дж. Нейрохим . 75, 480–486. doi: 10.1046/j.1471-4159.2000.0750480.x
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Бузиер-Сор А.К., Вуазен П., Бушо В., Безансон Э., Франкони Дж. М. и Пеллерен Л. (2006). Конкуренция между глюкозой и лактатом как субстратами окислительной энергии как в нейронах, так и в астроцитах: сравнительное исследование ЯМР. евро. Дж. Нейроски . 24, 1687–1694. doi: 10.1111/j.1460-9568.2006.05056.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Brekke, E.M., Walls, A. B., Schousboe, A., Waagepetersen, H.S., and Sonnewald, U. (2012). Количественное значение пентозофосфатного пути, определяемое включением 13 C из [2- 13 C]- и [3- 13 C]глюкозы в промежуточные продукты цикла ТСА и нейромедиаторные аминокислоты в функционально интактных нейронах. Дж. Цереб. Кровоток Метаб . 32, 1788–1799. doi: 10.1038/jcbfm.2012.85
B., Schousboe, A., Waagepetersen, H.S., and Sonnewald, U. (2012). Количественное значение пентозофосфатного пути, определяемое включением 13 C из [2- 13 C]- и [3- 13 C]глюкозы в промежуточные продукты цикла ТСА и нейромедиаторные аминокислоты в функционально интактных нейронах. Дж. Цереб. Кровоток Метаб . 32, 1788–1799. doi: 10.1038/jcbfm.2012.85
Полный текст CrossRef | Google Scholar
Сердан С., Кюннеке Б. и Силиг Дж. (1990). Церебральный метаболизм [1,2- 13 C 2 ]ацетата, обнаруженный с помощью in vivo и in vitro 13 С ЯМР. Дж. Биол. Химия . 265, 12916–12926.
Реферат PubMed | Google Scholar
Чен З. и Чжун К. (2013). Расшифровка болезни Альцгеймера по нарушенному церебральному метаболизму глюкозы: последствия для диагностических и терапевтических стратегий. Прогр. Нейробиол . 108, 21–43. doi: 10.1016/j.pneurobio.2013.06.004
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Круз Ф. , Скотт С. Р., Баррозу И., Сантистебан П. и Сердан С. (1998). Онтогенез и клеточная локализация системы рециркуляции пирувата в головном мозге крыс. Дж. Нейрохим . 70, 2613–2619.
, Скотт С. Р., Баррозу И., Сантистебан П. и Сердан С. (1998). Онтогенез и клеточная локализация системы рециркуляции пирувата в головном мозге крыс. Дж. Нейрохим . 70, 2613–2619.
Реферат PubMed | Google Scholar
Дринген Р., Хёпкен Х. Х., Миних Т. и Рюдиг К. (2007). «Пентозофосфатный путь и метаболизм НАДФН». в Справочнике по нейрохимии и молекулярной нейробиологии , Vol. 5., Использование нейронной энергии , ред. Г. Динел и Г. Гибсон (Гейдельберг: Springer), 41–62.
Google Scholar
Фитцпатрик С.М., Хетерингтон Х.П., Бехар К.Л. и Шульман Р.Г. (1990). Поток от глюкозы к глутамату в мозге крысы in vivo , как определено с помощью 1H-наблюдаемой, 13 C-редактированной ЯМР-спектроскопии. Дж. Цереб. Кровоток Метаб . 10, 170–179.
Реферат PubMed | Google Scholar
Gaitonde, M.K., Murray, E., and Cunningham, VJ (1989). Влияние 6-фосфоглюконата на фосфоглюкозоизомеразу в головном мозге крысы in vitro и in vivo . Дж. Нейрохим . 52, 1348–1352. doi: 10.1111/j.1471-4159.1989.tb09178.x
Дж. Нейрохим . 52, 1348–1352. doi: 10.1111/j.1471-4159.1989.tb09178.x
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Гарсия-Ногалес П., Алмейда А. и Боланьос Дж. П. (2003). Пероксинитрит защищает нейроны от апоптоза, опосредованного оксидом азота. Ключевая роль активности глюкозо-6-фосфатдегидрогеназы в нейропротекции. Дж. Биол. Химия . 278, 864–874. doi: 10.1074/jbc.M206835200
Реферат PubMed | Полный текст CrossRef
Гудвин, Г.В., Коэн, Д.М., и Тэгтмейер, Х. (2001). [5- 3 H] глюкоза переоценивает гликолитический поток в изолированном рабочем сердце крысы: роль пентозофосфатного пути. утра. Дж. Физиол. Эндокринол. Метаб . 280, Е502–Е508.
Реферат PubMed | Google Scholar
Эрреро-Мендес А., Алмейда А., Фернандес Э., Маэстре К., Монкада С. и Боланьос Дж. П. (2009). Биоэнергетический и антиоксидантный статус нейронов контролируется непрерывной деградацией ключевого гликолитического фермента с помощью APC/C-Cdh2. Нац. Клеточный Биол . 11: 747–752. doi: 10.1038/ncb1881
Нац. Клеточный Биол . 11: 747–752. doi: 10.1038/ncb1881
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Хозерсолл, Дж. С., Бакер, Н. З., Гринбаум, А. Л., и Маклин, П. (1979). Альтернативные пути утилизации глюкозы в головном мозге. Изменения характера утилизации глюкозы в мозге в процессе развития и влияние феназина метосульфата на интеграцию метаболических путей. Арх. Биохим. Биофиз . 198, 478–492. дои: 10.1016/0003-9861(79)
-8
Реферат PubMed | Полный текст перекрестной ссылки | Google Scholar
Джалло И., Карпентер К. Л., Грайс П., Хоу Д. Дж., Мейсон А., Галлахер С. Н. и др. (2015). Гликолиз и пентозофосфатный путь после черепно-мозговой травмы человека: исследования микродиализа с использованием 1,2-(13)C2 глюкозы. Дж. Цереб. Кровоток Метаб . 35, 111–120. doi: 10.1038/jcbfm.2014.177
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Канамацу Т. и Цукада Ю. (1994). Измерение метаболизма аминокислот, полученных из [1- 13 C]глюкозы, в мозге крыс с использованием 13 C магнитно-резонансной спектроскопии. Нейрохим. Рез . 19, 603–612.
Нейрохим. Рез . 19, 603–612.
Реферат PubMed | Google Scholar
Кац Дж., Рогнстад Р. и Кемп Р. Г. (1965). Эффекты изотопной дискриминации в метаболизме тритиевой глюкозы. Дж. Биол. Химия . 240, ПК1484-ПК1486.
Реферат PubMed | Google Scholar
Ларраби, М. Г. (1989). Пентозный цикл (гексозомонофосфатный шунт). Тщательная оценка пределов потока глюкозы с использованием данных 14 CO 2 с применением к периферическим ганглиям куриных эмбрионов. Дж. Биол. Химия . 264, 15875–15879.
Реферат PubMed | Google Scholar
Маккенна, М. К., Стивенсон, Дж. Х., Хуанг, X., Тилдон, Дж. Т., Зилке, С. Л., и Хопкинс, И. Б. (2000). Активность митохондриального яблочного фермента значительно выше в митохондриях синаптических окончаний коры по сравнению с митохондриями первичных культур нейронов коры или гранулярных клеток мозжечка. Нейрохим. . 36, 451–459. doi: 10.1016/S0197-0186(99)00148-5
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Нили, Дж. Р., Дентон, Р. М., Ингланд, П. Дж., и Рэндл, П. Дж. (1972). Влияние усиленной работы сердца на трикарбоксилатный цикл и его взаимодействие с гликолизом в перфузируемом сердце крысы. Биохим. Дж . 128, 147–159.
Р., Дентон, Р. М., Ингланд, П. Дж., и Рэндл, П. Дж. (1972). Влияние усиленной работы сердца на трикарбоксилатный цикл и его взаимодействие с гликолизом в перфузируемом сердце крысы. Биохим. Дж . 128, 147–159.
Реферат PubMed | Google Scholar
Олстад Э., Олсен Г. М., Ку Х. и Сонневальд У. (2007). Рециркуляция пирувата в культивируемых нейронах мозжечка. Дж. Неврологи. Рез . 85, 3318–3325. doi: 10.1002/jnr.21208
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Пеллерин Л. и Маджистретти П. Дж. (1994). Поглощение глутамата астроцитами стимулирует аэробный гликолиз: механизм, связывающий активность нейронов с утилизацией глюкозы. Проц. Натл. акад. науч. США . 91, 10625–10629.
Реферат PubMed | Google Scholar
Родригес-Родригес П., Фернандес Э. и Боланьос Дж. П. (2013). Недооценка пентозофосфатного пути в интактных первичных нейронах, выявленная при анализе метаболических потоков. Дж. Цереб. Кровоток Метаб . 33, 1843–1845 гг. doi: 10.1038/jcbfm.2013.168
33, 1843–1845 гг. doi: 10.1038/jcbfm.2013.168
PubMed Abstract | Полный текст перекрестной ссылки | Google Scholar
Росс Б.Д., Кингсли П.Б. и Бен-Йосеф О. (1994). Измерение активности пентозофосфатного пути при однократной инкубации с [1,6- 13 C 2 ,6,6- 2 H 2 ]глюкозой. Биохим. Дж . 302, 31–38.
Реферат PubMed | Google Scholar
Фогель Р., Дженнеманн Г., Зейтц Дж., Визингер Х. и Хампрехт Б. (1998). Митохондриальный яблочный фермент: очистка из бычьего мозга, получение антисыворотки и иммуноцитохимическая локализация в нейронах мозга крысы. Дж. Нейрохим . 71, 844–852.
Реферат PubMed | Google Scholar
Вамелинк М.М., Струйс Э.А. и Джейкобс К. (2008). Биохимия, метаболизм и наследственные дефекты пентозофосфатного пути: обзор. Дж. Наследовать. Метаб. Дис . 31, 703–717. doi: 10.1007/s10545-008-1015-6
PubMed Abstract | Полный текст перекрестной ссылки | Академия Google
| Номер пьезы | Описание | Фабрикантес | ПДФ |
| БУ941ЗЭ3 | Планарный эпитаксиальный транзистор NPN | Систэк Электроникс | ПДФ |
| БУ941ЗФ3 | Эпитаксиальный планарный транзистор NPN | Систэк Электроникс | ПДФ |
| БУ941ЗФП | Планарный эпитаксиальный транзистор NPN | Систэк Электроникс | ПДФ |
| БУ941ЗР3 | Эпитаксиальный планарный транзистор NPN | Систэк Электроникс | ПДФ |
| CDK3405 | Тройной видео ЦАП | Экзар | ПДФ |
| CLC1007 | Высокоскоростные усилители RRO | Экзар | ПДФ |
| CLC1008 | Rail-to-Rail усилители 75 МГц | Экзар | ПДФ |
| CLC1009 | Rail-to-Rail усилители 35 МГц | Экзар | ПДФ |
| CLC1010 | Rail-to-Rail усилители 7,3 МГц | Экзар | ПДФ |
| CLC1020 | Усилители Rail-to-Rail | Экзар | ПДФ |
| CLC1200 | Инструментальный усилитель | Экзар | ПДФ |
| CLC1606 | Усилитель с обратной связью по току 1,3 ГГц | Экзар | ПДФ |
| CLC2000 | Двойные и счетверенные усилители с высоким выходным током | Экзар | ПДФ |
| CLC2007 | Высокоскоростные усилители RRO | Экзар | ПДФ |
Una ficha técnica, hoja técnica u hoja de datos (datasheet на английском языке), también ficha de características u hoja de características, es un documento que резюме el funcionamiento y otras caracteristicas de un componente (por ejemplo, un componente electronico) o subsistema por ejemplo, una fuente de alimentación) con el suficiente detalle para ser utilizado por un ingeniero de diseño y diseñar el componente en un sistema. |

 Такие аккумуляторы наилучшим образом годились для них, поскольку могли использоваться в каком угодно положении. И до настоящего времени они эксплуатируются на истребителях F16.
Такие аккумуляторы наилучшим образом годились для них, поскольку могли использоваться в каком угодно положении. И до настоящего времени они эксплуатируются на истребителях F16. Если сравнивать со свинцово-кислотным аккумулятором – он выше на 50-75%, что дорогого стоит при запуске зимой.
Если сравнивать со свинцово-кислотным аккумулятором – он выше на 50-75%, что дорогого стоит при запуске зимой.