Содержание
Катализатор | это… Что такое Катализатор?
У этого термина существуют и другие значения, см. Катализатор (значения).
Схема протекания реакции с катализатором
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Содержание
|
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции.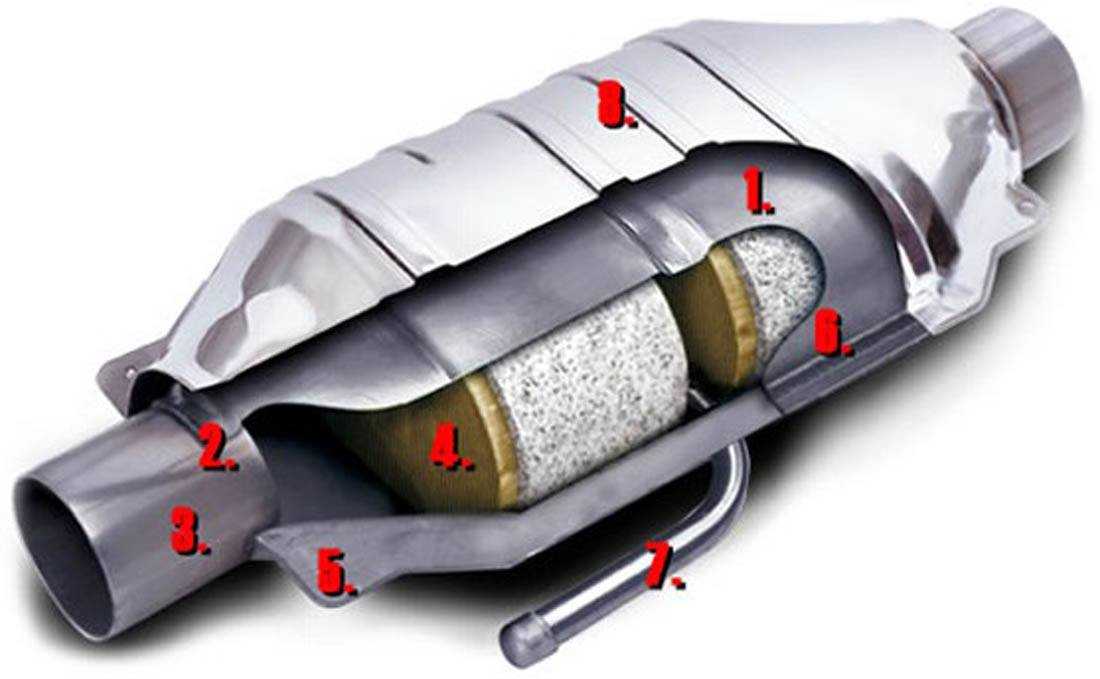 Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Основная статья: Каталитический конвертер
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
 [4]
[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
- Ингибитор
- Ферментативный ингибитор
- Активатор (катализ)
- Энергия активации
- Катализ
Ссылки
Катализатор | это.
 .. Что такое Катализатор?
.. Что такое Катализатор?
У этого термина существуют и другие значения, см. Катализатор (значения).
Схема протекания реакции с катализатором
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Содержание
|
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Основная статья: Каталитический конвертер
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.
 [4]
[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
- Ингибитор
- Ферментативный ингибитор
- Активатор (катализ)
- Энергия активации
- Катализ
Ссылки
Химические реакции и катализаторы — Science Learning Hub
Добавить в коллекцию
Химическая реакция включает химическое изменение, которое происходит при взаимодействии двух или более частиц (которые могут быть молекулами, атомами или ионами) . Например, когда железо и кислород реагируют, они превращаются в новое вещество, оксид железа (ржавчина). Оксид железа по своим химическим свойствам отличается от железа и кислорода. Это отличается от физического изменения. Например, вода может превратиться в лед, но лед остается водой в другом физическом состоянии — лед и вода имеют одинаковые химические свойства.
Например, когда железо и кислород реагируют, они превращаются в новое вещество, оксид железа (ржавчина). Оксид железа по своим химическим свойствам отличается от железа и кислорода. Это отличается от физического изменения. Например, вода может превратиться в лед, но лед остается водой в другом физическом состоянии — лед и вода имеют одинаковые химические свойства.
Когда химические вещества вступают в реакцию, частицы должны столкнуться друг с другом с достаточной энергией, чтобы произошла реакция. Чем чаще они сталкиваются, тем больше вероятность того, что они отреагируют. Не все столкновения приводят к реакциям — часто для этого не хватает энергии.
Некоторые реакции происходят быстрее, чем другие. Скорость зависит от вероятности столкновения между частицами. На скорость реакции влияет ряд факторов.
- Концентрация – Чем больше частиц, тем выше вероятность столкновения.
- Температура — Частицы больше перемещаются при более высоких температурах, поэтому вероятность столкновений выше, и у столкновений больше энергии.

- Давление – Частицы в газах сильно разбросаны. Если вы увеличиваете давление, частицы сталкиваются вместе, поэтому шансы на столкновение увеличиваются.
- Площадь поверхности – Если одним из реагирующих химических веществ является твердое тело, могут столкнуться только частицы на поверхности. Чем больше поверхность, тем быстрее реакция. Более мелкие частицы имеют большую площадь поверхности для своего размера, чем более крупные. Это объясняет, почему порошок обычно реагирует быстрее, чем комки.
- Катализаторы – Катализатор представляет собой вещество, которое изменяет скорость химической реакции, но остается химически неизменным в конце реакции. Ингибитор действует наоборот – замедляет химические реакции.
Катализаторы
Катализаторы играют важную роль во многих химических процессах. Они увеличивают скорость реакции, не расходуются в ходе реакции и необходимы только в очень малых количествах.
Катализаторы работают двумя основными способами.
Адсорбция
Частицы прилипают к поверхности катализатора (так называемая адсорбция), а затем перемещаются, что повышает вероятность их столкновения и реакции. Хорошим примером является то, как работает платиновый катализатор в автомобильном каталитическом нейтрализаторе, превращая токсичный монооксид углерода в менее токсичный диоксид углерода.
Промежуточные соединения
В этом процессе катализатор сначала соединяется с химическим веществом для получения нового соединения. Это новое соединение нестабильно, поэтому оно распадается, высвобождая другое новое соединение и оставляя катализатор в своей первоначальной форме. Так работают многие ферменты (специальные биологические катализаторы). Многие промышленные химические процессы основаны на таких катализаторах.
Один из примеров катализатора, который включает промежуточное соединение, можно найти высоко в атмосфере Земли. Там, наверху, химический озон (с молекулами, содержащими три атома кислорода) помогает защитить Землю от вредного ультрафиолетового излучения. Но также там есть хлор, который попадает в атмосферу из химикатов (хлорфторуглеродов, фреонов), используемых в некоторых холодильниках, кондиционерах и аэрозольных баллончиках.
Но также там есть хлор, который попадает в атмосферу из химикатов (хлорфторуглеродов, фреонов), используемых в некоторых холодильниках, кондиционерах и аэрозольных баллончиках.
Хлор – катализатор, который крадет атом кислорода у озона (O 3 ), оставляя стабильный кислород (O 2 ). В то же время он образует нестабильное промежуточное хлор-кислородное соединение, которое распадается с выделением своего кислорода. Это позволяет хлору свободно повторять процесс. Один атом хлора может каждую секунду разрушать около миллиона молекул озона. Это может сильно повлиять на способность атмосферы защищать нас от УФ-излучения.
Идея занятия
В этом видеоролике «Обучение учащихся тому, как учиться» Дэйв Корнер объясняет, как он использует ресурсы Хаба для обучения катализаторам.
Полезная ссылка
Посмотрите демонстрацию действия платины в качестве катализатора с объяснением использования платины в каталитических нейтрализаторах в этом видео от BBC.
Опубликовано 28 мая 2008 г., обновлено 10 апреля 2014 г. Ссылки на концентраторы
Перейти к полному глоссарию
Добавить 0 пунктов в коллекцию
Скачать 0 пунктов
Загрузка All
.
Chem4Kids.com: Реакции: Катализаторы и ингибиторы
Материя |
Атомы |
Элементы |
Периодическая таблица |
Реакции |
Биохимия |
Все темы
Обзор |
Тарифы |
Измерение |
Термодинамика |
Стехиометрия
Равновесие I II |
Катализаторы и ингибиторы |
Кислоты и основания I II
Катализатор похож на добавление немного волшебства в химическую реакцию. Реакции требуют определенного количества энергии, чтобы произойти. Если у них его нет, да ладно, реакции, вероятно, не произойдет. Катализатор снижает количество необходимой энергии, чтобы реакция могла происходить легче. Катализатор — это энергия. Если вы наполните комнату газообразным водородом (H 2 ) и газообразным кислородом (O 2 ), произойдет очень мало. Если вы зажжете спичку в этой комнате (или просто произведете искру), большая часть водорода и кислорода соединится, чтобы создать молекулы воды (H 2 О). Это взрывная реакция. Вы также можете добавить катализатор в эту комнату и запустить одну небольшую реакцию. В этой ситуации вы можете добавить немного палладия (Pd), который будет действовать как катализатор.
Реакции требуют определенного количества энергии, чтобы произойти. Если у них его нет, да ладно, реакции, вероятно, не произойдет. Катализатор снижает количество необходимой энергии, чтобы реакция могла происходить легче. Катализатор — это энергия. Если вы наполните комнату газообразным водородом (H 2 ) и газообразным кислородом (O 2 ), произойдет очень мало. Если вы зажжете спичку в этой комнате (или просто произведете искру), большая часть водорода и кислорода соединится, чтобы создать молекулы воды (H 2 О). Это взрывная реакция. Вы также можете добавить катализатор в эту комнату и запустить одну небольшую реакцию. В этой ситуации вы можете добавить немного палладия (Pd), который будет действовать как катализатор.
Энергия, необходимая для осуществления реакции, называется энергией активации . Поскольку все движется вокруг, необходима энергия. Энергия, необходимая для реакции, обычно находится в форме тепла. Когда добавляется катализатор, происходит нечто особенное. Может быть, молекула меняет свою структуру. Может быть, этот катализатор заставляет две молекулы соединяться, и они высвобождают тонну энергии. Эта дополнительная энергия может помочь другой реакции произойти в чем-то, что называется цепная реакция . Вы также можете подумать о катализаторе, таком как мост в некоторых случаях. Вместо того, чтобы позволить реакциям протекать таким же (но более быстрым) образом, он может предложить новое направление или химический путь, чтобы пропустить этапы, требующие энергии.
Когда добавляется катализатор, происходит нечто особенное. Может быть, молекула меняет свою структуру. Может быть, этот катализатор заставляет две молекулы соединяться, и они высвобождают тонну энергии. Эта дополнительная энергия может помочь другой реакции произойти в чем-то, что называется цепная реакция . Вы также можете подумать о катализаторе, таком как мост в некоторых случаях. Вместо того, чтобы позволить реакциям протекать таким же (но более быстрым) образом, он может предложить новое направление или химический путь, чтобы пропустить этапы, требующие энергии.
Катализаторы также используются в организме человека. Они не вызывают взрывов, но могут вызвать очень сложные реакции. Они помогают объединяться очень большим молекулам. Есть еще один интересный факт о катализаторах. Вы знаете, что катализаторы снижают энергию активации, необходимую для протекания реакции. Чем ниже энергия активации, тем легче комбинировать продукты. Следовательно, и прямая, и обратная реакции ускоряются. Он изменяет обе скорости и обычно изменяет точку равновесия.
Он изменяет обе скорости и обычно изменяет точку равновесия.
Существует также нечто, называемое ингибитором , который работает прямо противоположным образом, как катализаторы. Ингибиторы замедляют скорость реакции. Иногда они даже полностью останавливают реакцию. Вы можете спросить: «Зачем они кому-то нужны?» Вы можете использовать ингибитор, чтобы замедлить реакцию и сделать ее более контролируемой. Без ингибиторов некоторые реакции могли бы продолжаться и продолжаться. Если бы они это сделали, все молекулы были бы израсходованы. Это было бы плохо, особенно для вашего тела. Когда вы смотрите телевизор, у вас нет причин расщеплять сахар с такой же скоростью, как если бы вы занимались спортом.
► СЛЕДУЮЩАЯ СТРАНИЦА ПО ХИМИЧЕСКИМ РЕАКЦИЯМ
► СЛЕДУЮЩАЯ ОСТАНОВКА ТУРА ПО САЙТУ
► ВИКТОРИНА ПО РЕАКЦИЯМ
► ВЕРНУТЬСЯ НА НАЧАЛО СТРАНИЦЫ
► Или выполните поиск по сайтам.
 [4]
[4] [4]
[4]