Содержание
Назначение и расположение катализатора в автомобиле
Практически с самого начала создания автомобиля и до сегодня у конструкторов стоит несколько вопросов, над которыми они постоянно «бьются». Один из этих вопросов – максимальное снижение выбросов вредных веществ в атмосферу, ведь при сгорании топлива в цилиндрах двигателя появляется отработанные газы, которые в своем составе имеют ядовитые элементы. А поскольку эти газы отводятся во внешнюю среду – значит, отравляющие вещества выходят из силовой установки авто постоянно, пока она работает.
Одним из самых действенных способов снижения вредных выбросов авто, который является вполне распространенным – использование каталитического нейтрализатора, в народе называющийся сокращенно катализатором.
Для того чтобы понять, для чего нужен этот нейтрализатор, упомянем немного теории.
Теоретическая часть
Устройство автомобильного катализатора
Выхлопной газ, выходящий из цилиндров силового агрегата состоит из многих элементов, выделившихся в результате химической реакции, которой и является горение. Некоторые из этих элементов вполне безвредны, а вот такие как окись углерода (СО), углеводороды (СН) и оксиды азота (NO и NO2) являются достаточно опасными. Чтобы уменьшить их содержание в выхлопе двигателя, ученые решили эти химические соединения еще раз подвергнуть хим. реакции. Для этого им пришлось использовать дорогостоящие металлы — платиноиридиевый сплав, палладий, родий. Вступая с ними в реакцию, вредные химические элементы окисляются, из-за чего после реакции на выходе получаются углекислый газ (CO2) и азот (N2) – вещества вполне безвредные. Конечно, полностью ядовитые элементы катализатор удалить не способен, но значительно уменьшить их – вполне.
Некоторые из этих элементов вполне безвредны, а вот такие как окись углерода (СО), углеводороды (СН) и оксиды азота (NO и NO2) являются достаточно опасными. Чтобы уменьшить их содержание в выхлопе двигателя, ученые решили эти химические соединения еще раз подвергнуть хим. реакции. Для этого им пришлось использовать дорогостоящие металлы — платиноиридиевый сплав, палладий, родий. Вступая с ними в реакцию, вредные химические элементы окисляются, из-за чего после реакции на выходе получаются углекислый газ (CO2) и азот (N2) – вещества вполне безвредные. Конечно, полностью ядовитые элементы катализатор удалить не способен, но значительно уменьшить их – вполне.
Даже стандарты ЕВРО, постоянно ожесточающиеся, подразумевают определенное наличие опасных веществ, которые автомобили не должны превышать. В некоторых странах за экологией следят очень серьезно, поэтому авто, не соответствующие определенным нормам ЕВРО, и не оснащенные катализаторами, продавать и использовать запрещено.
Несколько слов о металлах, которые выступают нейтрализаторами. Они отличаются по химической реакции с вредными веществами. Так, палладий и сплав на основе платины являются окислительными, то есть, при вступлении в реакцию с вредными веществами, они их окисляют, разделяя на безвредные вещества.
Они отличаются по химической реакции с вредными веществами. Так, палладий и сплав на основе платины являются окислительными, то есть, при вступлении в реакцию с вредными веществами, они их окисляют, разделяя на безвредные вещества.
Родий же является нейтрализатором восстановительным. Он при реакции оксиды азота восстанавливает до обычного безвредного азота.
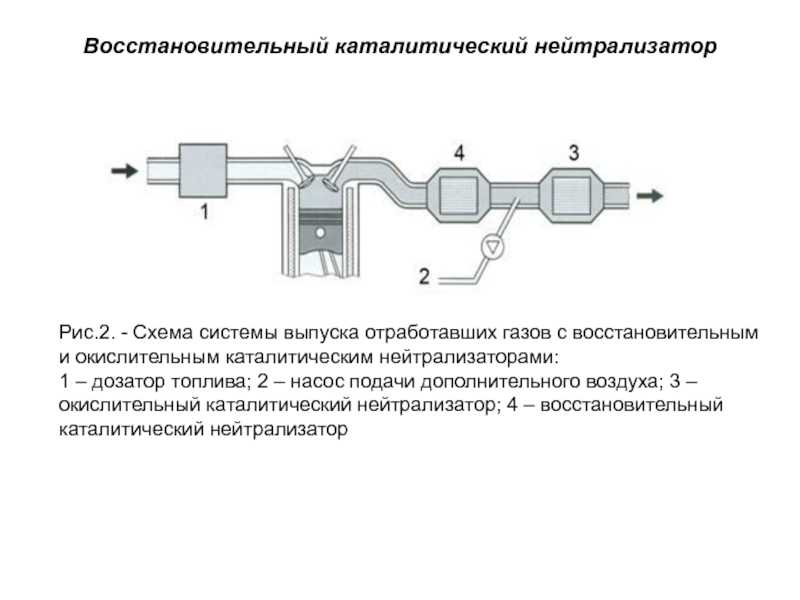
На деле все происходит так: выхлопные газы и выпускного коллектора подаются в емкость, где находится специальная бобина с нейтрализующим металлом, проходя через которую, часть вредных веществ химически нейтрализуется, а затем уже выхлопной газ идет дальше – в резонатор и глушитель.
Сейчас все чаще применяются все три металла в одном катализаторе на авто – для улучшенной очистки отработанных газов. То есть, внутри катализатора размещаются одна за другой три бобины, каждая со своим металлом.
Конструкция катализатора
А теперь более подробно об устройстве катализатора. Располагается он зачастую за выпускным коллектором. Состоит он из корпуса, утеплителя и блок-носителя – той самой бобины.
Состоит он из корпуса, утеплителя и блок-носителя – той самой бобины.
О корпусе особо говорить нечего – герметичная жестяная емкость с двумя выходами для установки ее в систему отвода выхлопных газов. Утеплитель предотвращает просачивание газов мимо блок-носителя. Помимо этого, он сохраняет температуру, необходимую для протекания реакций. Дело в том, что быстрее всего реакции, при которых нейтрализуются вредные вещества проходят при температуре не менее 300 град. Поэтому зачастую нейтрализатор и располагается сразу за коллектором.
Принцип работы катализатора
А вот сами блок-носители по конструкции довольно интересны. Указанные металлы являются очень дорогостоящими, поэтому сделать один блок-носитель полностью из этого металла – удовольствие невыгодное. Поэтому основой для блок-носителя выступает керамика, сделанная в виде сотов. На поверхность этих сотов и наносится слой нейтрализующих металлов. Такая конструкция позволяет не только снизить расход дорогих металлов, но еще и по максимуму увеличить площадь контакта металла с газами.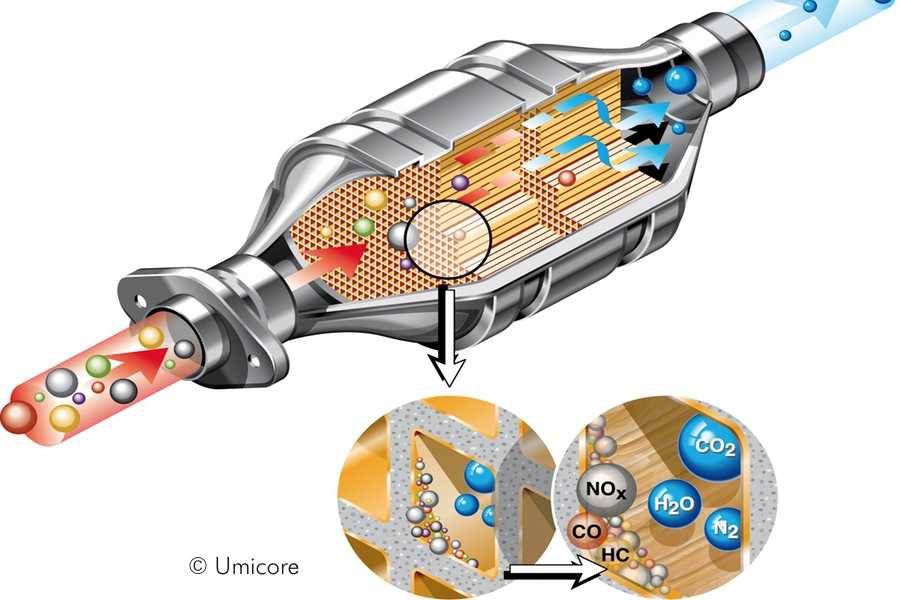
Некоторые блок-носители состоят из свернутой в рулон керамической ленты с сотами, поэтому в разрезе она похожа на бобину. Но это не всегда так, есть и блок-носители, похожий на сигаретный фильтр, но только значительно увеличенный в размерах.
Работа катализатора
Одной из особенностей использования катализатора на авто является то, что бортовой компьютер следит за его работой. Для этого в систему отвода включены лямбда-зонды. В авто, которое не оснащено катализатором, данный зонд только один и нужен он для определения количества остаточного кислорода в отработанных газах для коррекции работы системы питания.
Расположение катализатора в выхлопной системе. Кислородные датчики — это и есть лямбда-зонды
А вот в машине с каталитическим нейтрализатором таких лямбда-зондов два, первый установлен перед и катализатором и он определяет состав выхлопных газов для системы питания. Второй располагается за катализатором и определяет он состав выхлопных газов уже прошедших дополнительную очистку. После бортовой компьютер сравнивает показания двух зондов.
После бортовой компьютер сравнивает показания двух зондов.
Если значения будут выравниваться, это укажет на выход из строя катализатора, о чем просигнализирует индикатор «Check engine».
Неисправности каталитического нейтрализатора
Все дело в том, что катализатор не вечен и со временем выходит из строя. Средний срок службы его составляет около 100 тыс. км. Если авто прошло такой километраж, и возникли проблемы с катализатором – это укажет на естественный износ. В таком случае слой нейтрализующих металлов с поверхности керамических сотов выгорел и выхлопные газы уже не очищаются.
Видео: Как пробить катализатор
Однако проблемы с катализатором могут возникнуть и значительно раньше. Виной тому может стать нарушенная работа системы зажигания или питания. По их вине может пройти засорение сотов сажей и другими продуктами горения, после чего работа катализатора нарушается.
Еще причиной поломки катализатора может стать некачественный бензин, особенно это проблема актуальна у нас. Часто для повышения октанового числа в бензин добавляется тетраметилсвинец. Октан он хоть и повышает, но в цилиндрах полностью не сгорает, а выходя из цилиндров – оседает на поверхности сотов блок-носителя, после чего катализатор перестает действовать.
Устранение проблем в работе
Решений проблем, возникших с каталитическим нейтрализатором – несколько. Первая и самая простая – замена катализатора на оригинальный. То есть, обращаетесь к официальным дилерам, они заказывают новый элемент, заменяют его и авто продолжает эксплуатироваться дальше. Но в этом есть одна значительная проблема – стоимость. Сейчас производители авто поступают по-хитрому – зачастую выпускной коллектор выполнен заодно с катализатором. А поскольку сам катализатор – не дешевый, а еще если и добавить коллектор, то и вовсе сумма за ремонт может выйти приличной.
Вторым способом решения проблемы является установка универсального катализатора. При этом восстановление работоспособности авто может обойтись значительно дешевле. Для авто подбирается определенная модель катализатора, подходящая по параметрам автомобиля. Далее неисправный катализатор вырезается из системы отвода выхлопных газов, на его место вваривается новый – универсальный.
При этом восстановление работоспособности авто может обойтись значительно дешевле. Для авто подбирается определенная модель катализатора, подходящая по параметрам автомобиля. Далее неисправный катализатор вырезается из системы отвода выхлопных газов, на его место вваривается новый – универсальный.
Видео: Катализатор и пламегаситель, сравнение до и после, 0-100(120) км\ч Nissan Almera N16 QG15DE
И последний способ восстановления – замена катализатора на пламегаситель. Это самый «варварский» способ. Катализатор с выхлопной трубы вырезается, на его место вваривается пламегаситель, он же предварительный резонатор, который стабилизирует поток выхлопных газов при прохождении через него, но он никаких очистных работ не проводит. После производится перепрошивка бортового компьютера, и проблем с катализатором больше не возникает.
Как работает катализатор и сажевый фильтр
Катализатор или каталитический нейтрализатор/конвертер – это своего рода фильтр современного автомобиля, являющийся неотъемлемой частью его выхлопной системы и призванный снизить токсичность газов, вырабатываемых двигателем.
В этой логике катализатор располагается в автомобиле в зависимости от его конструкции, являясь «прокладкой» между двигателем и выхлопной трубой.
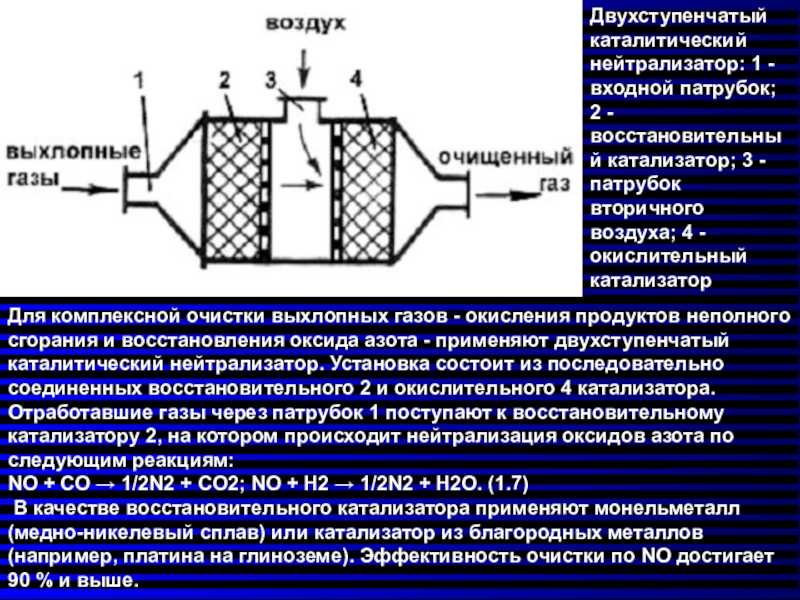
Катализаторы различаются степенью переработки вредных веществ или экологическим классом (евро 2,3,4,5,6), материалом изготовления сот (металлические, керамические), количеством каталитических блоков (двухкомпонентные, трехкомпонентные), и в зависимости от типа двигателя (дизельный или бензиновый). Но принцип работы катализатора примерно одинаковый.
Двигатель вырабатывает газы в виде оксида азота, моно оксида углерода и несгорающих компонентов топлива, которые через соединительные системы автомобиля поступают в катализатор и выходят из него за долю секунды.
За эту долю секунды конвертер перерабатывает газы, выбрасывая пары воды и кислород.
Для примера более подробно рассмотрим принцип работы двухкомпонентного катализатора с металлическими сотами и максимальным наполнением драгоценными металлами, который по конструкции выглядит следующим образом.
Под нержавеющей крышкой такого катализатора расположены два нержавеющих блока, каждый из которых состоит из тысячи каналов или сот. Блоки с боковых сторон покрыты драгоценными металлами. Первый блок покрывается платиной и родием, а второй – платиной и палладием. Такое «драгоценное» покрытие и его сочетание обеспечивает необходимую реакцию с токсичными газами, в результате которой образуются безопасные для здоровья человека газы. Преимущество такого покрытия также в том, что драгоценные металлы не поддаются коррозии.
Микро-каналы или соты внутри блока также играют важную роль, так как призваны увеличить поверхность контакта металла с газами, которая по объему составляет огромную площадку, при этом сам катализатор небольших размеров.
Каким образом газы из токсичных превращаются в нетоксичные? Для этого необходима высокая температура, чтобы произошла химическая реакция и в этом случае конвертер достигает высокой температуры (порядка 750 градусов по Цельсию) в процессе движения автомобиля.
Раскаленные токсичные газы выходят из двигателя при температуре около 500 градусов по Цельсию. Химические реакции, происходящие внутри конвертера, также выделяют тепло, разогревая его и заставляя работать на полную мощность при переработке молекул газа.
Молекулы оксида азота и моно оксида углерода вместе с несгорающими компонентами топлива попадают в катализатор и проникают в соты.
Когда газы поступают в первый блок, платина, родий и оксид азота вступают в реакцию. Эти металлы притягивают к себе молекулы кислорода, а свободные атомы азота взаимодействуют между собой. В результате такого взаимодействия оксид азота превращается в кислород и азот, которые вместе составляют 99% того, чем мы дышим.
Дальше газы поступают во второй блок, в котором тысячи микро каналов покрыты платиной и палладием. Эти драгоценные металлы притягивают кислород. Высокие температуры заставляют объединяться моно оксид углерода с еще одной частицей кислорода. Таким образом, химическая реакция дает углекислый газ.
Таким образом, химическая реакция дает углекислый газ.
Молекулы негорючих веществ также при максимально высоких температурах начинают взаимодействовать с молекулами кислорода, и в результате такого взаимодействия получается еще больше углекислого газа и воды.
Таким образом, происходит превращение токсичных веществ в нетоксичные.
Катализаторы (сажевые фильтры) являются штатной конструкцией автомобиля, но забиваются значительно быстрее срока службы автомобиля, в среднем спустя 5 лет после эксплуатации.
Забитый катализатор перестает выполнять свою функцию и приводит к выходу из строя выхлопной системы и двигателя автомобиля.
Наши клининговые машины эффективно очищают катализатор и сажевый фильтр от 98 до 99,8% его первоначальных заводских характеристик и, таким образом, увеличивают срок службы автомобиля.
Берегите себя, свой автомобиль и дышите свободно.
14.7: Катализ — Химия LibreTexts
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 25181
Цели обучения
- Понять, как катализаторы увеличивают скорость реакции и селективность химических реакций.
Катализаторы — это вещества, которые увеличивают скорость химической реакции, не расходуясь в процессе. Катализатор, таким образом, не входит в общую стехиометрию реакции, которую он катализирует, но он должен присутствовать хотя бы в одной из элементарных реакций механизма катализируемой реакции. Катализированный путь имеет более низкую E a , но чистое изменение энергии в результате реакции (разница между энергией реагентов и энергией продуктов) не зависит от присутствия катализатора ( Рисунок \(\PageIndex{1}\)). Тем не менее, из-за его более низкой E a , скорость катализируемой реакции выше, чем скорость некаталитической реакции при той же температуре. Поскольку катализатор снижает высоту энергетического барьера, его присутствие увеличивает скорость как прямой, так и обратной реакции на одинаковую величину. В этом разделе мы рассмотрим три основных класса катализаторов: гетерогенные катализаторы, гомогенные катализаторы и ферменты.
Тем не менее, из-за его более низкой E a , скорость катализируемой реакции выше, чем скорость некаталитической реакции при той же температуре. Поскольку катализатор снижает высоту энергетического барьера, его присутствие увеличивает скорость как прямой, так и обратной реакции на одинаковую величину. В этом разделе мы рассмотрим три основных класса катализаторов: гетерогенные катализаторы, гомогенные катализаторы и ферменты.
Рисунок \(\PageIndex{1}\): Снижение энергии активации реакции катализатором. На этом графике сравниваются диаграммы потенциальной энергии для одностадийной реакции в присутствии и в отсутствие катализатора. Единственный эффект катализатора заключается в снижении энергии активации реакции. Катализатор не влияет на энергию реагентов или продуктов (и, следовательно, не влияет на ΔE). (CC BY-NC-SA; анонимно) Зеленая линия представляет некатализируемую реакцию. Фиолетовая линия представляет катализируемую реакцию.
Катализатор влияет на E a , а не на Δ E .
Гетерогенный катализ
В гетерогенном катализе катализатор находится в другой фазе, чем реагенты. По крайней мере, один из реагентов взаимодействует с твердой поверхностью в физическом процессе, называемом адсорбцией, таким образом, что химическая связь в реагенте становится слабой, а затем разрывается. Яды — это вещества, которые необратимо связываются с катализаторами, препятствуя адсорбции реагентов и, таким образом, снижая или разрушая эффективность катализатора.
Примером гетерогенного катализа является взаимодействие газообразного водорода с поверхностью металла, такого как Ni, Pd или Pt. Как показано в части (а) на рисунке \(\PageIndex{2}\), связи водород-водород разрываются и образуются отдельные адсорбированные атомы водорода на поверхности металла. Поскольку адсорбированные атомы могут перемещаться по поверхности, два атома водорода могут столкнуться и образовать молекулу газообразного водорода, которая затем может покинуть поверхность в обратном процессе, называемом десорбцией. Адсорбированные атомы H на поверхности металла значительно более реакционноспособны, чем молекула водорода. Поскольку относительно прочная связь H–H (энергия диссоциации = 432 кДж/моль) уже разорвана, энергетический барьер для большинства реакций H 2 находится значительно ниже на поверхности катализатора.
Адсорбированные атомы H на поверхности металла значительно более реакционноспособны, чем молекула водорода. Поскольку относительно прочная связь H–H (энергия диссоциации = 432 кДж/моль) уже разорвана, энергетический барьер для большинства реакций H 2 находится значительно ниже на поверхности катализатора.
Рисунок \(\PageIndex{2}\): Гидрирование этилена на гетерогенном катализаторе. Когда молекула водорода адсорбируется на поверхности катализатора, связь Н–Н разрывается и образуются новые связи М–Н. Отдельные атомы H более реакционноспособны, чем газообразные H 2 . Когда молекула этилена взаимодействует с поверхностью катализатора, она взаимодействует с атомами водорода в ступенчатом процессе с образованием этана, который высвобождается. (CC BY-NC-SA; анонимно)
На рисунке \(\PageIndex{2}\) показан процесс, называемый гидрированием , в котором атомы водорода добавляются к двойной связи алкена, такого как этилен, с получением продукта, содержащего одинарные связи C–C, в в данном случае этан. Гидрогенизация используется в пищевой промышленности для превращения растительных масел, состоящих из длинных цепей алкенов, в более коммерчески ценные твердые производные, содержащие алкильные цепи. Гидрогенизация некоторых двойных связей в полиненасыщенных растительных маслах, например, дает маргарин, продукт с температурой плавления, текстурой и другими физическими свойствами, подобными свойствам сливочного масла.
Гидрогенизация используется в пищевой промышленности для превращения растительных масел, состоящих из длинных цепей алкенов, в более коммерчески ценные твердые производные, содержащие алкильные цепи. Гидрогенизация некоторых двойных связей в полиненасыщенных растительных маслах, например, дает маргарин, продукт с температурой плавления, текстурой и другими физическими свойствами, подобными свойствам сливочного масла.
Несколько важных примеров промышленных гетерогенных каталитических реакций приведены в таблице \(\PageIndex{1}\). Хотя механизмы этих реакций значительно сложнее, чем описанная здесь простая реакция гидрирования, все они включают адсорбцию реагентов на твердой каталитической поверхности, химическую реакцию адсорбированных частиц (иногда через ряд промежуточных частиц) и, наконец, десорбцию. продуктов с поверхности.
| Коммерческий процесс | Катализатор | Начальная реакция | Конечный коммерческий продукт |
|---|---|---|---|
| контактный процесс | В 2 О 5 или Pt | 2SO 2 + O 2 → 2SO 3 | H 2 SO 4 |
| Процесс Габера | Fe, K 2 O, Al 2 O 3 | N 2 + 3H 2 → 2NH 3 | НХ 3 |
| Процесс Оствальда | Pt и Rh | 4NH 3 + 5O 2 → 4NO + 6H 2 O | HNO 3 |
| реакция конверсии вода–газ | Fe, Cr 2 O 3 или Cu | CO + H 2 O → CO 2 + H 2 | H 2 для NH 3 , CH 3 OH и другие виды топлива |
| паровой риформинг | Ni | CH 4 + H 2 O → CO + 3H 2 | Ч 2 |
| синтез метанола | ZnO и Cr 2 O 3 | CO + 2H 2 → CH 3 OH | CH 3 ОН |
| Процесс Сохио | фосфомолибдат висмута | \(\ mathrm{CH}_2\textrm{=CHCH}_3+\mathrm{NH_3}+\mathrm{\frac{3}{2}O_2}\стрелка вправо\mathrm{CH_2}\textrm{=CHCN}+\ матрм{3H_2O}\) | \(\ underset{\textrm{акрилонитрил}}{\mathrm{CH_2}\textrm{=CHCN}}\) |
| каталитическое гидрирование | Ni, Pd или Pt | RCH=CHR’ + h3 → RCH 2 -CH 2 R’ | частично гидрогенизированные масла для маргарина и т. д. д. |
Гомогенный катализ
В гомогенном катализе катализатор находится в той же фазе, что и реагент(ы). Количество столкновений между реагентами и катализатором максимально, потому что катализатор равномерно распределен по всей реакционной смеси. Многие гомогенные катализаторы в промышленности представляют собой соединения переходных металлов (таблица \(\PageIndex{2}\)), но извлечение этих дорогостоящих катализаторов из раствора представляет собой серьезную проблему. В качестве дополнительного препятствия для их широкого коммерческого использования многие гомогенные катализаторы можно использовать только при относительно низких температурах, и даже в этом случае они имеют тенденцию к медленному разложению в растворе. Несмотря на эти проблемы, в последние годы был разработан ряд коммерчески жизнеспособных процессов. Полиэтилен высокой плотности и полипропилен получают методом гомогенного катализа.
| Коммерческий процесс | Катализатор | Реагенты | Конечный продукт |
|---|---|---|---|
| Юнион Карбайд | [Rh(CO) 2 I 2 ] − | СО + СН 3 ОХ | CH 3 CO 2 H |
| гидропероксидный процесс | Комплексы Mo(VI) | CH 3 CH=CH 2 + R–O–O–H | |
| гидроформилирование | Rh/PR 3 комплексы | RCH=CH 2 + CO + H 2 | РЧ 2 CH 2 CH |
| адипонитриловый процесс | Ni/PR 3 комплексы | 2HCN + CH 2 =CHCH=CH 2 | NCCH 2 CH 2 CH 2 CH 2 CN используется для синтеза нейлона |
| полимеризация олефинов | (RC 5 H 5 ) 2 ZrCl 2 | CH 2 =CH 2 | –(CH 2 CH 2 –) n : полиэтилен высокой плотности |
Ферменты
Ферменты, катализаторы, встречающиеся в естественных условиях в живых организмах, представляют собой почти все белковые молекулы с типичной молекулярной массой 20 000–100 000 а. е.м. Некоторые из них представляют собой гомогенные катализаторы, которые реагируют в водном растворе внутри клеточного компартмента организма. Другие представляют собой гетерогенные катализаторы, встроенные в мембраны, которые отделяют клетки и клеточные компартменты от их окружения. Реагент в реакции, катализируемой ферментом, называется подложка .
е.м. Некоторые из них представляют собой гомогенные катализаторы, которые реагируют в водном растворе внутри клеточного компартмента организма. Другие представляют собой гетерогенные катализаторы, встроенные в мембраны, которые отделяют клетки и клеточные компартменты от их окружения. Реагент в реакции, катализируемой ферментом, называется подложка .
Поскольку ферменты могут многократно увеличивать скорость реакции (до 10 17 раз по сравнению с некатализируемой скоростью) и имеют тенденцию быть очень специфичными, обычно производя только один продукт с количественным выходом, они находятся в центре активных исследований. В то же время получение ферментов обычно дорого, они часто перестают функционировать при температурах выше 37 °С, имеют ограниченную стабильность в растворе и настолько высокую специфичность, что ограничиваются превращением одного конкретного набора реагентов в один конкретный продукт. . Это означает, что для химически сходных реакций должны быть разработаны отдельные процессы с использованием разных ферментов, что требует много времени и средств.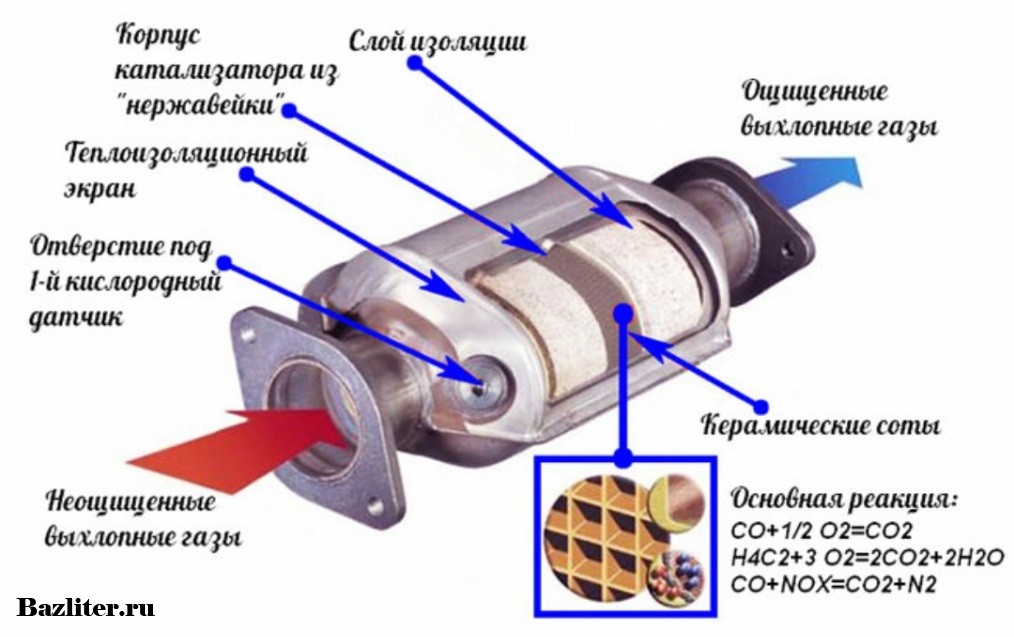 До настоящего времени ферменты нашли лишь ограниченное промышленное применение, хотя они используются в качестве ингредиентов в моющих средствах для стирки, чистящих средствах для контактных линз и размягчителях мяса. Ферменты в этих приложениях, как правило, представляют собой протеазы, которые способны расщеплять амидные связи, удерживающие вместе аминокислоты в белках. Размягчители мяса, например, содержат протеазу, называемую папаином, которую выделяют из сока папайи. Он расщепляет некоторые из длинных волокнистых белковых молекул, которые делают недорогие куски говядины жесткими, в результате чего получается более нежный кусок мяса. Некоторые насекомые, такие как жук-бомбардировщик, содержат фермент, способный катализировать разложение перекиси водорода до воды (рис. \(\PageIndex{3}\)).
До настоящего времени ферменты нашли лишь ограниченное промышленное применение, хотя они используются в качестве ингредиентов в моющих средствах для стирки, чистящих средствах для контактных линз и размягчителях мяса. Ферменты в этих приложениях, как правило, представляют собой протеазы, которые способны расщеплять амидные связи, удерживающие вместе аминокислоты в белках. Размягчители мяса, например, содержат протеазу, называемую папаином, которую выделяют из сока папайи. Он расщепляет некоторые из длинных волокнистых белковых молекул, которые делают недорогие куски говядины жесткими, в результате чего получается более нежный кусок мяса. Некоторые насекомые, такие как жук-бомбардировщик, содержат фермент, способный катализировать разложение перекиси водорода до воды (рис. \(\PageIndex{3}\)).
Рисунок \(\PageIndex{3}\): Каталитический защитный механизм. Обжигающие зловонные брызги, испускаемые этим жуком-бомбардиром, образуются в результате каталитического разложения \(\ce{h3O2}\).
Ингибиторы ферментов вызывают снижение скорости реакции, катализируемой ферментом, путем связывания с определенной частью фермента и, таким образом, замедления или предотвращения реакции. Таким образом, необратимые ингибиторы являются эквивалентом ядов в гетерогенном катализе. Одним из старейших и наиболее широко используемых коммерческих ингибиторов ферментов является аспирин, который избирательно ингибирует один из ферментов, участвующих в синтезе молекул, вызывающих воспаление. Дизайн и синтез родственных молекул, которые являются более эффективными, селективными и менее токсичными, чем аспирин, являются важными задачами биомедицинских исследований.
Таким образом, необратимые ингибиторы являются эквивалентом ядов в гетерогенном катализе. Одним из старейших и наиболее широко используемых коммерческих ингибиторов ферментов является аспирин, который избирательно ингибирует один из ферментов, участвующих в синтезе молекул, вызывающих воспаление. Дизайн и синтез родственных молекул, которые являются более эффективными, селективными и менее токсичными, чем аспирин, являются важными задачами биомедицинских исследований.
Резюме
Катализаторы участвуют в химической реакции и увеличивают ее скорость. Они не входят в итоговое уравнение реакции и не расходуются в ходе реакции. Катализаторы позволяют реакции протекать по пути, который имеет более низкую энергию активации, чем некатализируемая реакция. В гетерогенном катализе катализаторы обеспечивают поверхность, с которой реагенты связываются в процессе адсорбции. В гомогенном катализе катализаторы находятся в одной фазе с реагентами. Ферменты — это биологические катализаторы, которые вызывают значительное увеличение скорости реакции и, как правило, специфичны для определенных реагентов и продуктов.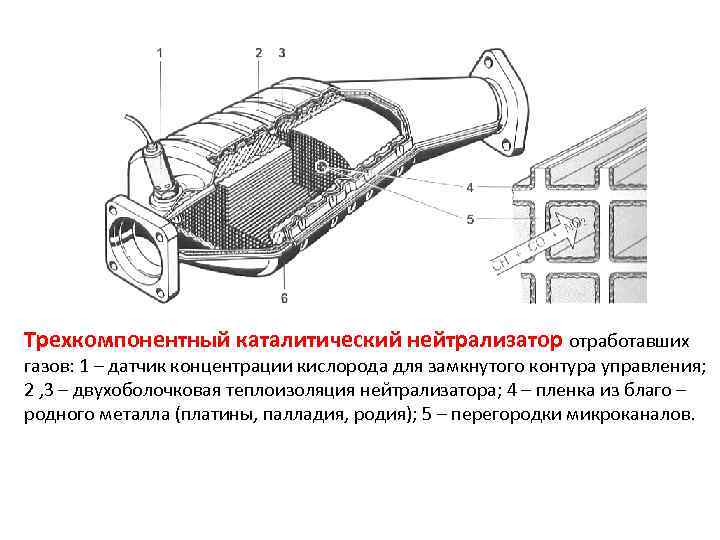 Реагент в реакции, катализируемой ферментом, называется субстратом. Ингибиторы ферментов вызывают снижение скорости реакции, катализируемой ферментом.
Реагент в реакции, катализируемой ферментом, называется субстратом. Ингибиторы ферментов вызывают снижение скорости реакции, катализируемой ферментом.
14.7: Catalysis распространяется под лицензией CC BY-NC-SA 3.0, автором, ремиксом и/или куратором является LibreTexts.
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Лицензия
- CC BY-NC-SA
- Версия лицензии
- 3,0
- Показать страницу TOC
- № на стр.
- Теги
- фермент
- гетерогенный катализ
- Гомогенный катализ
- подложка
7.
 4 Механизм реакции и катализ | Скорость и степень реакции
4 Механизм реакции и катализ | Скорость и степень реакции
Предыдущий 7.3 Измерение скорости реакции | Следующий 7.5 Краткое содержание главы |
7.4 Механизм реакции и катализ (ESCN8)
Ранее упоминалось, что именно столкновение частиц вызывает реакции на
происходят и что только некоторые из этих столкновений являются успешными. Это связано с тем, что реагент
частицы имеют широкий диапазон кинетических энергий, и только небольшая часть частиц будет
иметь достаточно энергии (и правильную ориентацию), чтобы действительно разорвать связи, так что химическое
может иметь место реакция.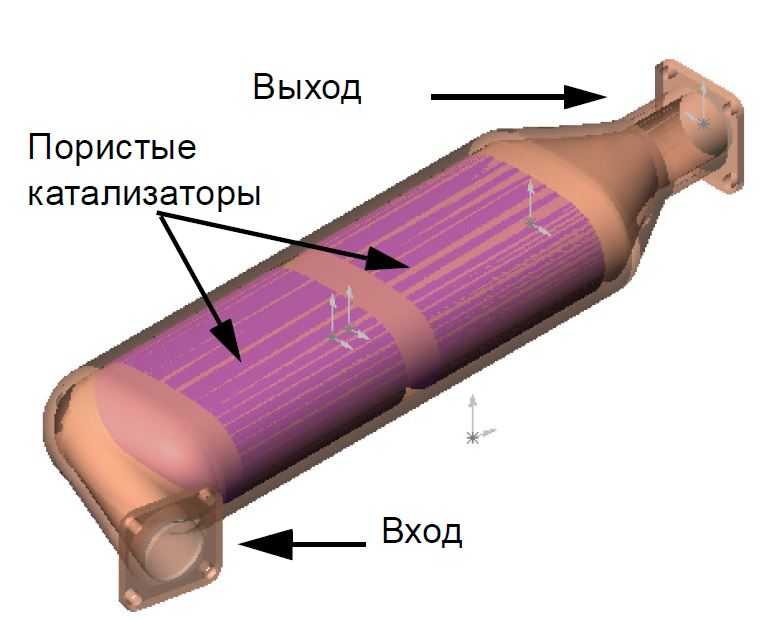 Минимальная энергия, необходимая для протекания реакции, равна
Минимальная энергия, необходимая для протекания реакции, равна
называется энергия активации . Для получения дополнительной информации об энергии реакций см.
обратитесь к 11 классу (глава
12).
Энергия активации (ESCN9)
- Энергия активации
Минимальная энергия, необходимая для протекания химической реакции.
Даже при фиксированной температуре энергия частиц меняется, а это означает, что только некоторые из
у них будет достаточно энергии, чтобы участвовать в химической реакции, в зависимости от
энергия активации этой реакции (рис.
7.9). Повышение температуры реакции приводит к увеличению
количество частиц с достаточной энергией, чтобы принять участие в реакции, и увеличение
скорость реакции.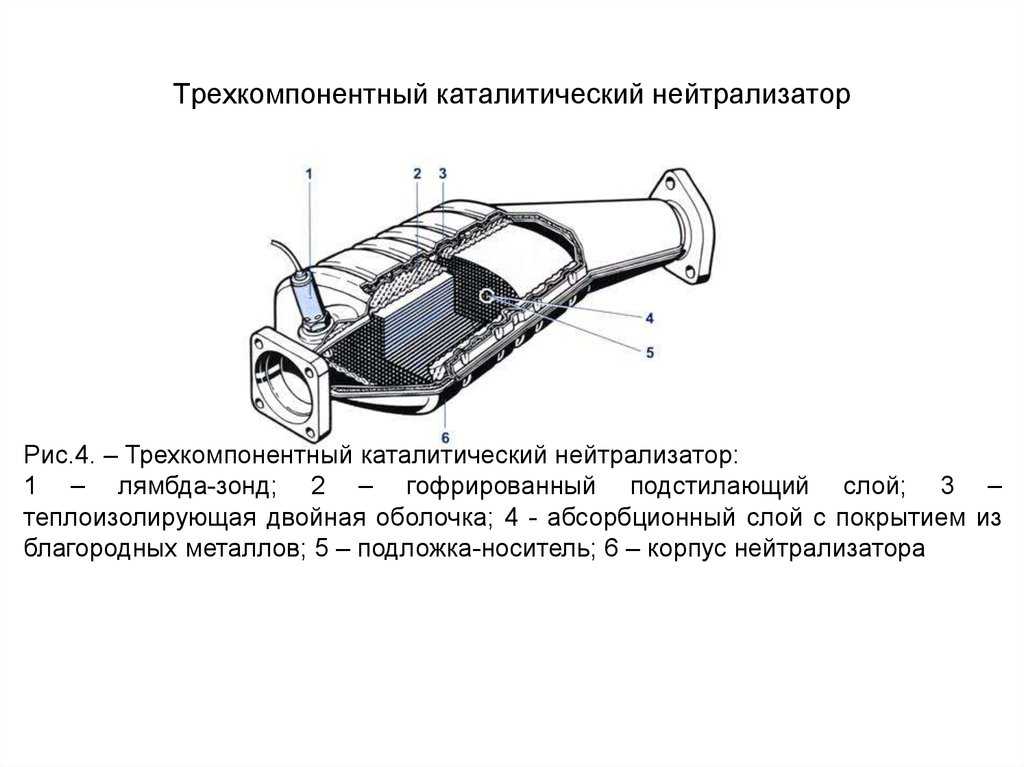
Рисунок 7.9: Распределение кинетических энергий частиц при фиксированном
температура.
Помните, что молекула должна иметь энергию большую, чем энергия активации, а также
правильная ориентация, чтобы реакция имела место.
Повышение температуры реакционной смеси увеличивает среднюю кинетическую энергию
частицы. Как видно на графике (рис. 7.10), более высокая доля частиц может
Теперь реагируйте, ускоряя реакцию. При усилении движения молекул
шансы молекулы иметь правильную ориентацию также увеличиваются.
Рисунок 7.10: Распределение кинетических энергий частиц с увеличением
в температуре. Увеличивается количество частиц с
достаточно энергии из-за более высокой температуры.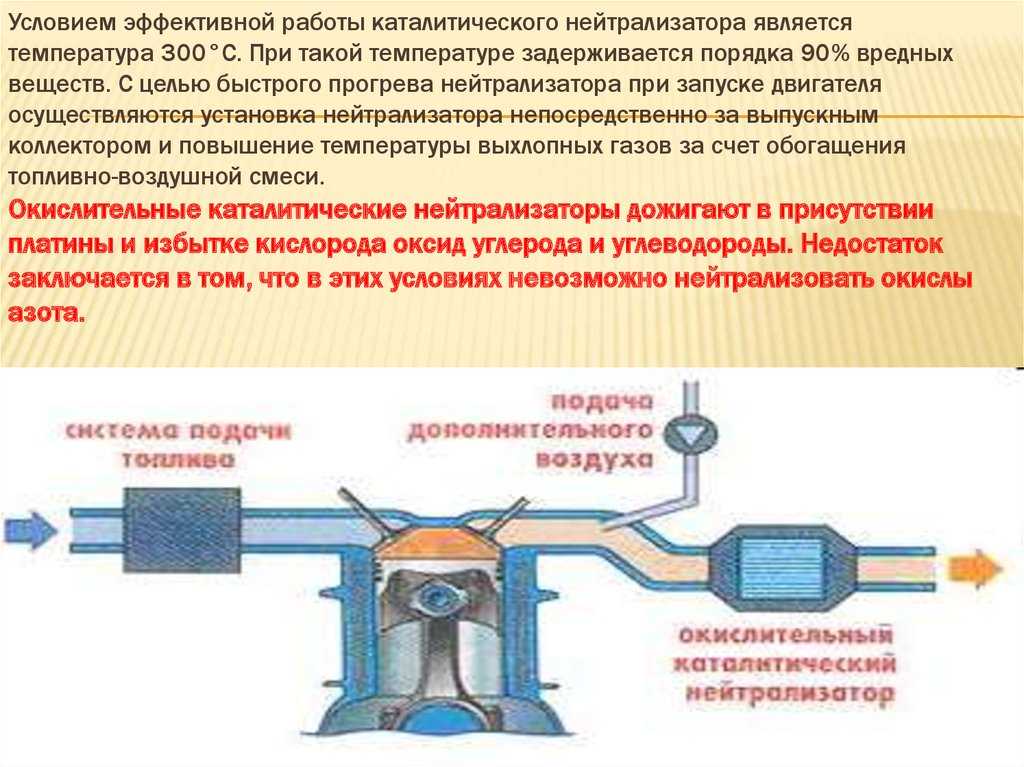
Эндотермическая реакция может быть представлена:
\(\text{Реагенты} + \color{red}{\text{Энергия}} \to \text{Продукты}\) т.е. реакция, которая
поглощает энергию
Это можно показать на диаграмме энергии активации (рис.
7.11). Эти графики также иногда называют профилем реакции или
график потенциальной энергии.
Рисунок 7.11: Диаграмма энергии активации с энергией реагента ниже, чем
энергия продукта, т.е. эндотермический
Экзотермическая реакция может быть представлена следующим образом:
\(\text{Reactants}\to \text{Products} + \color{red}{\text{Energy}}\) т.е. реакция, которая
высвобождает энергию
Это можно показать на диаграмме энергии активации (рис.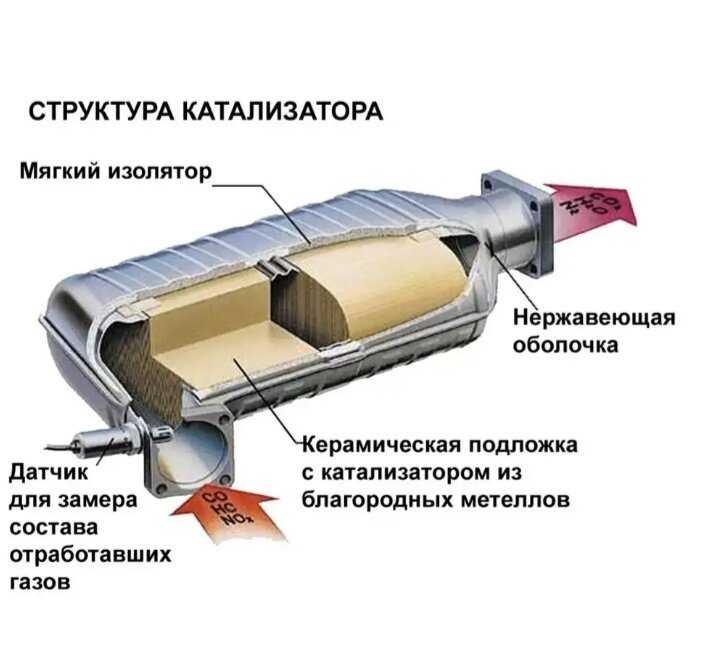
7.12):
Рисунок 7.12: Диаграмма энергии активации с энергией реагента, превышающей
энергия продукта, т.е. экзотермический
Пересмотрите этот раздел, начиная с 11 класса (Активация).
энергии, раздел 12.3).
Как работают катализаторы? (ESCNB)
Катализатор увеличивает скорость реакции несколько иначе, чем другие
методы повышения скорости реакции. Функция катализатора заключается в снижении
энергии активации, так что большая часть частиц имеет достаточную энергию для
реагировать. Катализатор может снизить энергию активации реакции на:
Некоторые металлы напр. платина, медь и железо могут действовать как катализаторы в некоторых
реакции. В наших собственных телах есть ферментов, которые являются катализаторами, помогающими
В наших собственных телах есть ферментов, которые являются катализаторами, помогающими
ускоряют биологические реакции. Катализаторы обычно реагируют с одним или несколькими
реагентов с образованием промежуточного химического вещества, которое затем вступает в реакцию с образованием конечного продукта.
Химический промежуточный продукт иногда называют активировал комплекс .
Активированный комплекс возникает как в реакциях без катализаторов, так и в реакциях с
катализаторы.
Ниже приведен пример того, как может протекать реакция с участием катализатора. А и В
реагенты, \(\color{blue}{\text{C}}\) — катализатор, а D — продукт
реакция А и Б.
Шаг 1: \({\text{A}} + \color{blue}{\text{C}} \to
\text{A}\color{blue}{\text{C}}\)
Шаг 2: \(\text{B} + \text{A}\color{blue}{\text{C}} \to
\text{A}\color{blue}{\text{C}}\text{B}\)
Шаг 3: \(\text{A}\color{blue}{\text{C}}\text{B} \to \color{blue}{\text{C}}
+ \текст{Д}\)
\(\text{A}\color{blue}{\text{C}}\text{B}\) представляет промежуточный химикат. Хотя
Хотя
катализатор (\(\color{blue}{\text{C}}\)) потребляется реакцией 1, позже высвобождается
снова по реакции 3, так что общая реакция с катализатором выглядит следующим образом:
\(\text{A} + \text{B} + \color{blue}{\text{C}} \to \text{D} + \color{blue}{\text{C}}\)
Из этого видно, что катализатор высвобождается в конце реакции, полностью
без изменений. Без катализатора общая реакция была бы:
\(\text{A} + \text{B}\) \(\to\) \(\text{D}\)
Катализатор обеспечивает альтернативный набор стадий реакции, который мы называем
альтернативный путь. Путь с участием катализатора требует меньше энергии активации
и поэтому быстрее.
Это видно на следующей диаграмме (Рисунок 7.13).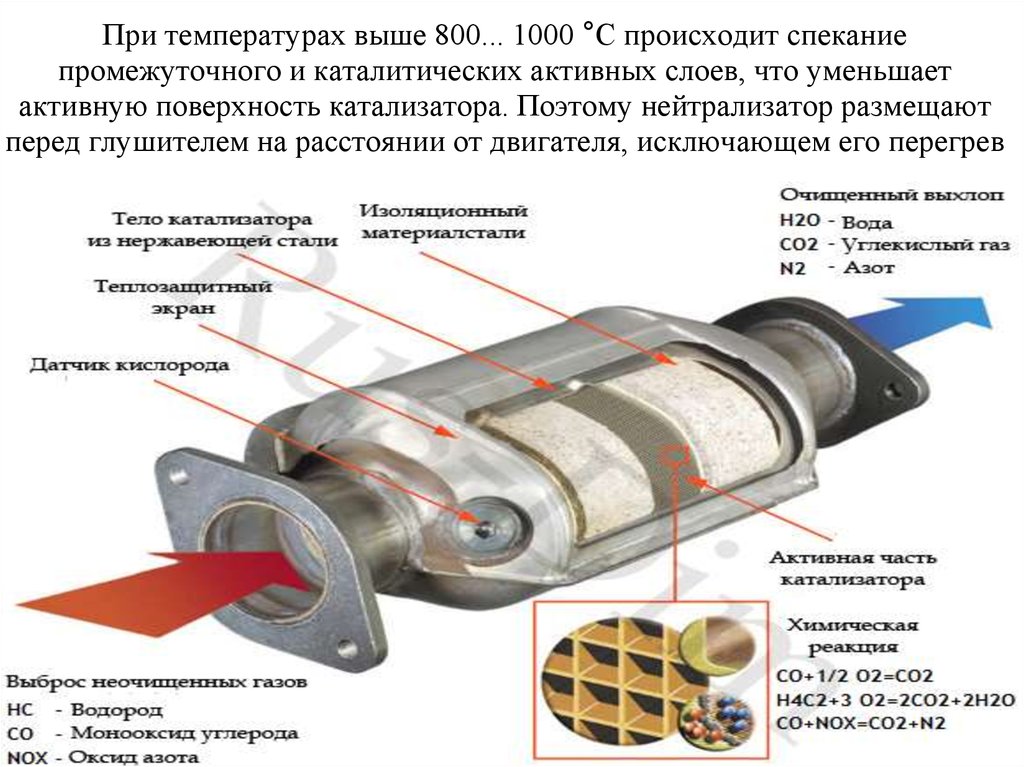
Рисунок 7.13: Доля частиц, обладающих достаточной энергией для реакции, равна
повышается в присутствии катализатора.
- Катализатор
Катализатор ускоряет химическую реакцию, не расходуясь при этом
реакция. Увеличивает скорость реакции за счет снижения активации
энергия для реакции.
Энергетические диаграммы полезны для иллюстрации влияния катализатора на
скорости реакции. Катализаторы уменьшают энергию активации, необходимую для реакции
протекают (показано меньшей величиной энергии активации на энергетической диаграмме
на рисунке 7. 14), и
14), и
следовательно, увеличить скорость реакции. Помните, что с катализатором средняя кинетическая
энергия молекул остается прежней, но требуемая энергия уменьшается (рис. 7.13).
Рисунок 7.14: Влияние катализатора на энергию активации
эндотермическая реакция. Катализатор будет действовать таким же образом для
экзотермическая реакция.
Скорость реакции
Учебник Упражнение 7.4
Катализатор увеличивает энергию молекул реагентов
чтобы могла произойти химическая реакция.
Ложь. Катализатор снижает энергию активации
реакция, так что химическая реакция может протекать
место.
Повышение температуры реакции
Эффект увеличения количества реагента
частиц, обладающих большей энергией, чем
энергия активации.
Правда
Катализатор не входит в состав конечного продукта
в химической реакции.
Верно
Почему в ходе реакции происходит уменьшение массы?
Реакция не протекает в герметичном
контейнер и поэтому газообразный водород может выйти
из реакционного сосуда.
Эксперимент повторяется, на этот раз с использованием 5 г
порошковый цинк вместо кусочков цинка. Как
Как
повлияет ли это на среднюю скорость
реакция?
Скорость увеличится, так как будет больше
площадь поверхности цинка для реакции с кислотой. 9{-3}$}\)
соляная кислота. Как изменяется средняя скорость
эту реакцию сравнить с
оригинал скорость реакции?
Имеется больший объем соляной кислоты.
Однако концентрация не увеличивается и
поэтому скорость реакции не меняется.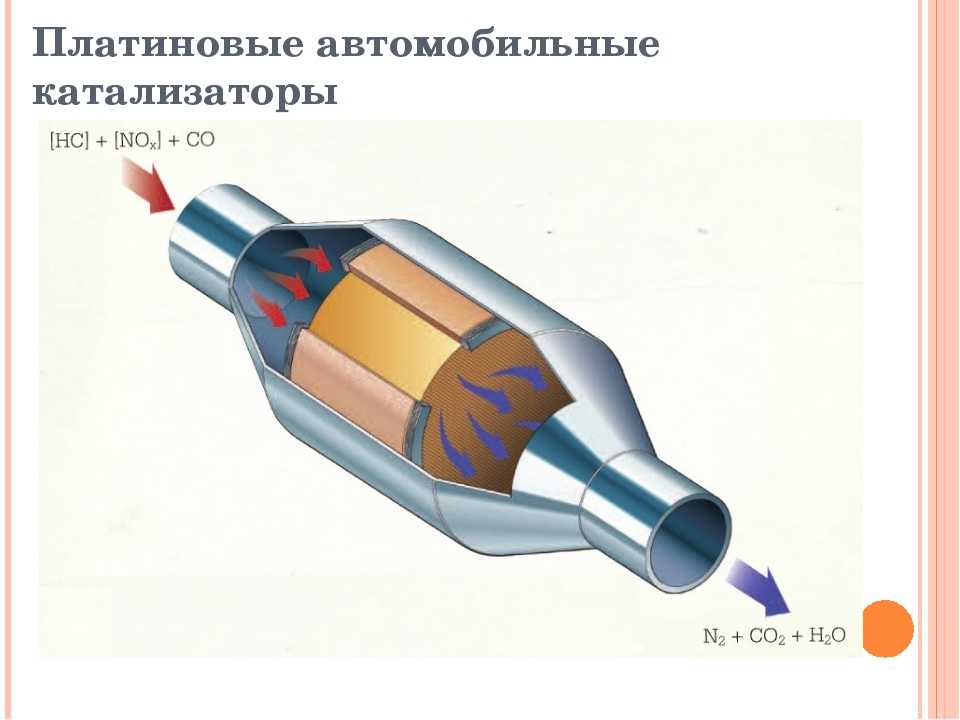
Какое влияние окажет катализатор на среднюю скорость
этой реакции?
(IEB Paper 2 2003)
Средняя скорость реакции увеличится.
Напишите сбалансированное химическое уравнение для этой реакции.
\(\text{CaCO}_{3}(\text{s}) + 2\text{HCl}(ℓ)\)
\(\to\) \(\text{CaCl}_{2}(\text{s}) +
\text{CO}_{2}(\text{g}) +
\текст{Н}_{2}\текст{О}(ℓ)\) 9{-3}$}\)
используется соляная кислота
Средняя скорость реакции зависит от
концентрация жидких реагентов и
не на громкости.