Содержание
Сколько платины содержится в катализаторах и как ее извлечь
Автомобильные катализаторы, впрочем, как и любые другие виды катализаторов, необходимы для ускорения протекания химической реакции. Какой?! В данном случае – для очищения отработанных газов перед тем, как они будут выброшены в атмосферу. Автомобильный катализатор представляет собой неизменяемый сплав нескольких металлов. Иными словами, катализатор – постоянен. Он не растворяется и не пропадает. Но благодаря тому, что в составе его сплава присутствуют и драгоценные металлы, он становится объектом коммерческого интереса многих автолюбителей.
Содержание
- Металлы, входящие в состав катализатора
- Извлечение драгоценных металлов
- Есть ли смысл извлекать металлы?!
- Промышленное извлечение драгоценных металлов
Металлы, входящие в состав катализатора
Если бы автомобильные катализаторы покрывались любым дешевым металлом, который был бы способен также катализировать вредные вещества, как делают это платина, родий, палладий и даже золото, то вряд ли к ним проявлялся бы такой интерес. Однако благодаря тому, что металлы – катализаторы, используемые чаще всего, входят в группу драгоценных металлов, и стоят на порядок выше золота, автомобильные катализаторы стали представлять определенную ценность. Сама конструкция катализатора выполняется из металла или керамики, и только ее покрытие выполнено с участием драгоценных металлов. Поэтому количество катализирующего вещества, которое можно извлечь из катализатора, крайне мало.
Однако благодаря тому, что металлы – катализаторы, используемые чаще всего, входят в группу драгоценных металлов, и стоят на порядок выше золота, автомобильные катализаторы стали представлять определенную ценность. Сама конструкция катализатора выполняется из металла или керамики, и только ее покрытие выполнено с участием драгоценных металлов. Поэтому количество катализирующего вещества, которое можно извлечь из катализатора, крайне мало.
Извлечение драгоценных металлов
Несмотря на то, что количество драгоценного вещества на корпусе автомобильного катализатора небольшое, его можно попытаться извлечь. Конечно же, результат будет ничтожным, да и частота металла будет оставлять лучшего. Но все же это будет драгоценный металл! Проблема заключается только в одном: чтобы извлечь металл из катализатора, понадобятся специальные химические реактивы, приобретение которых довольно дорогостоящее удовольствие. Да и не везде их можно найти!
Есть ли смысл извлекать металлы?!
В автомобильных катализаторах, производимых в разных частях мира, могут быть применены различные металлы – катализаторы, где-то это платина, а где-то – золото. Иногда в их составе можно обнаружить и серебро. Однако общее количество драгоценных металлов будет небольшим, порядка нескольких граммов.
Иногда в их составе можно обнаружить и серебро. Однако общее количество драгоценных металлов будет небольшим, порядка нескольких граммов.
Важно! Чем дороже металл, тем меньше его будет в катализаторе. Если это серебро, то можно рассчитывать на извлечение порядка 30-40 граммов. Но если это платина, то его количество может не превышать и 3 граммов!
Если учесть стоимость драгоценных металлов в перерасчете на 1 грамм, то можно прийти к выводу, что их извлечение имеет место. Однако финансовой выгоды от такого мероприятия не будет, поскольку приобретение реактивов, способствующих выделению данных металлов, потребует не малых средств.
Промышленное извлечение драгоценных металлов
Выгодно заниматься извлечение вещества – катализатора можно только в промышленном случае, когда одно и то же количество реактива способно отделить драгоценный металл ни с одного, а сразу с нескольких сотен катализаторов. Этим пользуются и специальные пункты по скупке металлолома и автомобильных комплектующих. Например, они скупают автомобильные аккумуляторы, ради последующего извлечения из них свинца, который затем выгодно продается производителям аккумуляторных батарей.
Например, они скупают автомобильные аккумуляторы, ради последующего извлечения из них свинца, который затем выгодно продается производителям аккумуляторных батарей.
Точно также они поступают и с катализаторами. Поэтому выгодней всего просто продать катализатор скупщику и получить от этой операции гораздо больше финансовой выгоды, чем от попыток самостоятельно извлечь металлы.
Как извлечь из катализатора драгоценные металлы
-
Главная - /
- Автовладельцам
- /
- Как извлечь драгоценные металлы из катализатора и зачем это нужно
30 июля 2020
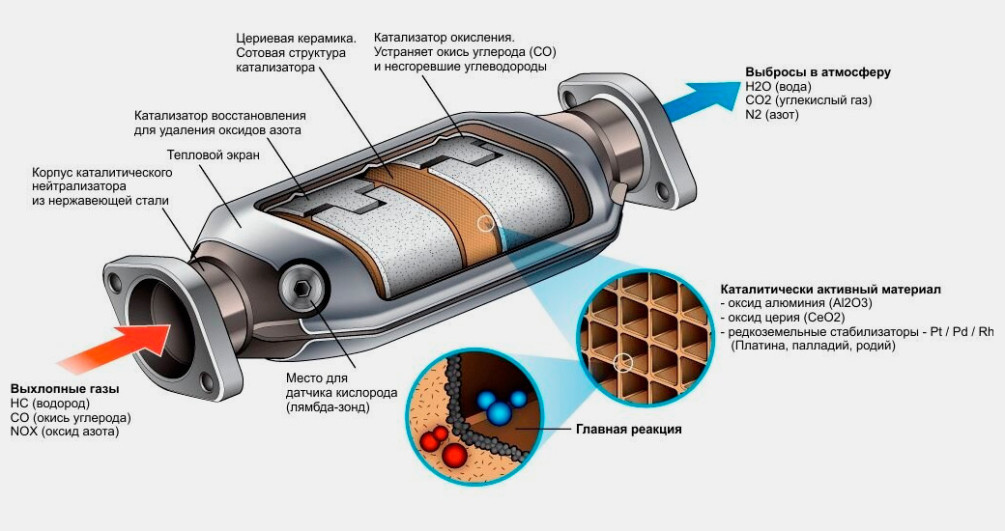
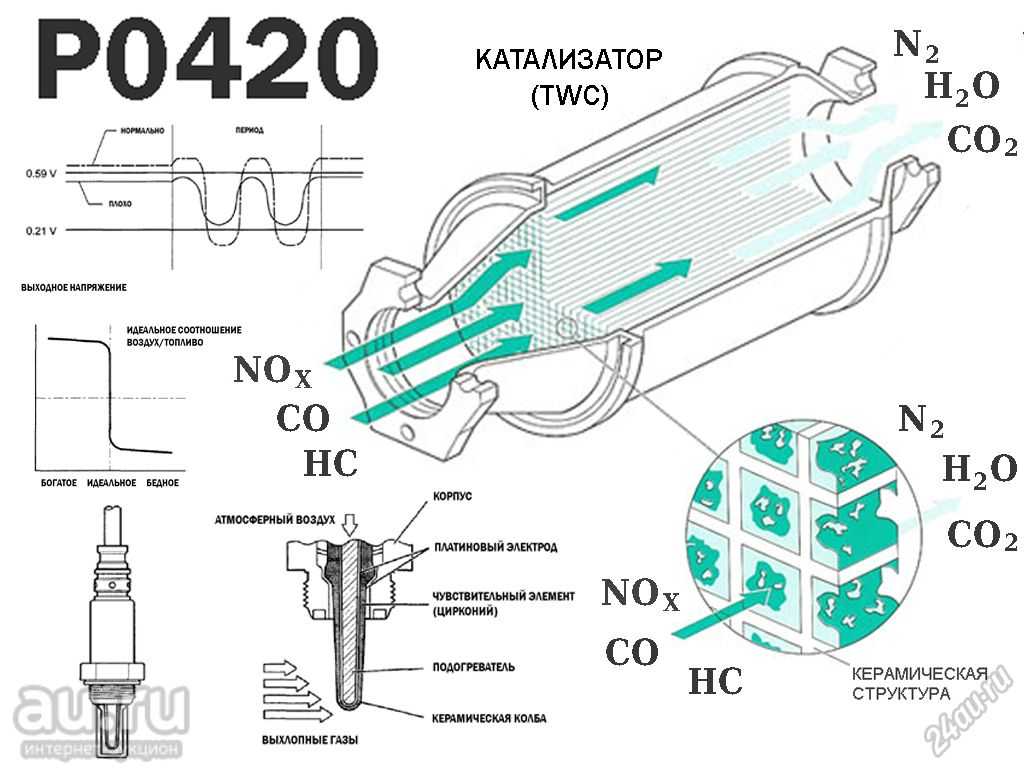
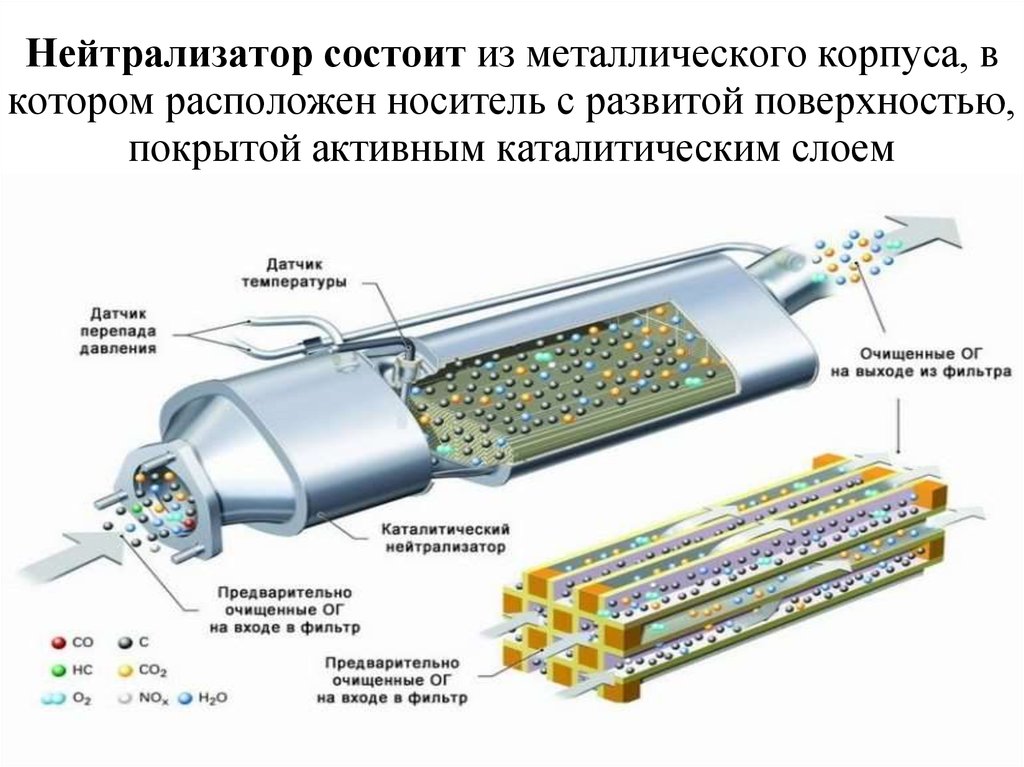
На протяжении последних 10 лет каталитические нейтрализаторы устанавливают на каждый выпускаемый автомобиль. Данные устройства отвечают за одну важную задачу – очистка отработанных газов и приведение их в соответствие требованиям экологических стандартов (в разных странах установлены различные нормативы). При воздействии специальных элементов токсичные вещества в автомобильных выхлопах преобразуются в совершенно безвредные компоненты (азот, вода, углекислый газ).
При воздействии специальных элементов токсичные вещества в автомобильных выхлопах преобразуются в совершенно безвредные компоненты (азот, вода, углекислый газ).
Это обеспечивается за счет догорания углеводородов, окиси углерода и окислов азота при воздействии высоких температур с участием кислорода. В этом процессе также участвуют каталитические вещества, которые представлены напылением драгоценных металлов (платины, палладия, родия). Благодаря таким химическим реакциям из выхлопной трубы автомобиля выходят абсолютно безвредные вещества, которые не загрязняют атмосферу и не оказывают негативных воздействий на организм человека.
Ценность внутренней «начинки» нейтрализаторов
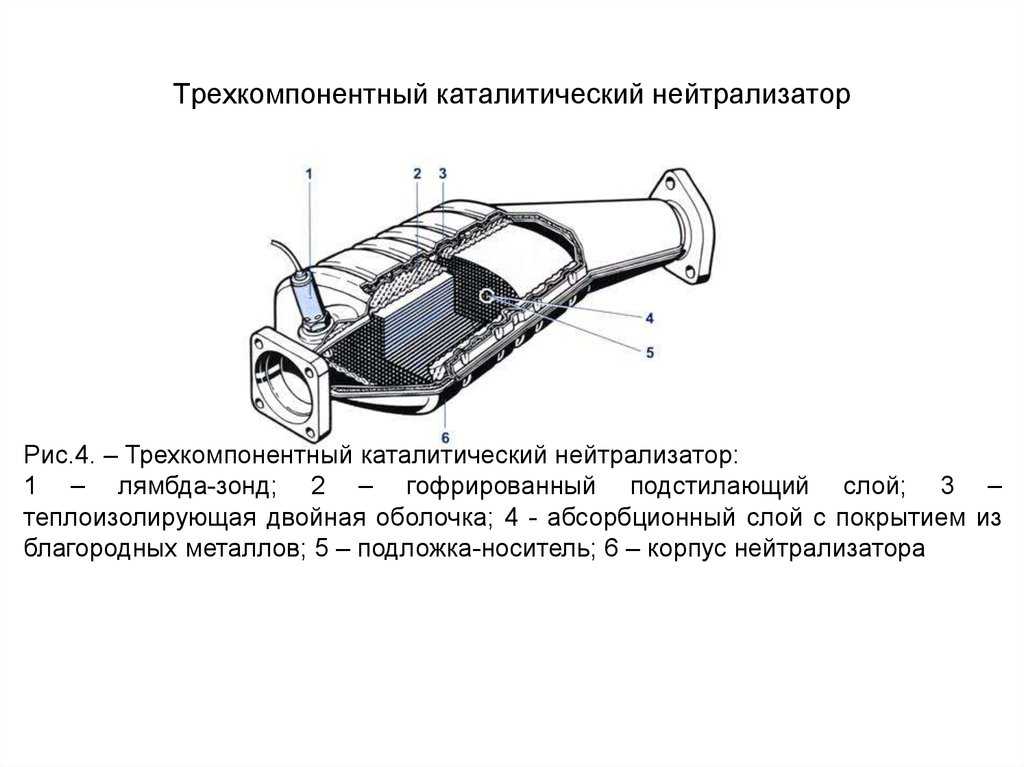
Каталитические конвертеры, представленные на сайте autocatalystmarket.com/ru/ru, устанавливаются в выхлопную систему и размещаются под днищем автомобиля. Они представлены в виде металлического кожуха и термоизолированного блока с мелкими керамическими сотами. На поверхность этих ячеек тонким слоем наносятся драгоценные металлы. При высоких температурах от +300 °С и соблюдении пропорции топлива/кислорода ускоряется проведение окислительно-восстановительных реакций.
На поверхность этих ячеек тонким слоем наносятся драгоценные металлы. При высоких температурах от +300 °С и соблюдении пропорции топлива/кислорода ускоряется проведение окислительно-восстановительных реакций.
Внутренняя ячеистая структура имеет общую площадь в десятки тысяч м2, при этом драгметаллы составляют от 0.05 до 0.8 % от массы самого устройства. Хотя вес сравнительно невелик, из-за высокой стоимости платины, палладия и родия неисправные катализаторы лучше не выбрасывать, а сдавать на разборку. Это позволит немного сэкономить на покупке нового нейтрализатора.
Как правило, ценность «начинки» автомобильных катализаторов зависит от ряда важных факторов:
- машины возрастом более 12-15 лет оснащаются нейтрализаторами, которые соответствуют менее жестким экологическим стандартам, поэтому содержат намного меньше драгоценных металлов;
- современные модели автомобилей оснащаются каталитическими конвертерами, которые должны отвечать требованиям стандартов Евро5 и Евро6, поэтому сотовая решетка в них имеет больше напыления драгметаллов;
- автопроизводители стараются улучшать качество моторов, поэтому новые силовые агрегаты требуют менее производительных очистных деталей, соответственно в нейтрализаторах используется меньше платины и палладия;
- катализаторы с трехкамерной конструкцией наиболее выгодны с точки зрения извлечения драгметаллов;
- конвертеры в машинах Jeep, Hummer, Mersedes, Lexus и Land Rover более дорогостоящие, чем устройства в авто отечественного производства.

Особенности извлечения катализаторов
Чтобы получить ценное сырье, соты нейтрализаторов обрабатывают механическим и химическим способом. Их измельчают и подвергают электролизу (или воздействиям активных средств). Для высвобождения родия и платины применяется процесс выщелачивания (на соты многократно воздействуют окисляющими смесями и промывками). Также может применяться пирометаллургическая методика (сотовую решетку дробят, нагревают до высокой температуры и периодически сливают примеси, получая гранулы драгметаллов). Для получения палладия используется гальванический метод и фторирование с расщеплением минеральными кислотами.
Как видите, процесс извлечения дорогостоящего сырья является довольно сложным, и выполнить его самостоятельно практически невозможно. Поэтому неисправные и изношенные нейтрализаторы лучше сдать в специализированные компании, которые занимаются их скупкой и обработкой.
Комментарии
Рекомендованные статьи
Catalyst — New World Encyclopedia
Каталитический нейтрализатор на Saab 9-5.
Чтобы произошла химическая реакция, требуется определенное минимальное количество энергии, называемое ее энергией активации . Если вещество может снизить эту энергию активации, не изменяясь и не расходуясь во время реакции, оно называется катализатором или катализатором . Действие катализатора называется катализом .
Катализатор снижает энергию активации, обеспечивая альтернативный путь протекания реакции. При этом катализатор заставляет реакцию протекать быстрее и при более низкой температуре, чем некатализируемая реакция. Кроме того, если данная реакция может производить множество продуктов, катализатор может помочь направить реакцию на образование определенной подгруппы продуктов.
Содержание
- 1 История и этимология
- 2 Общий каталитический процесс
- 3 Типы катализаторов
- 3.1 Гетерогенные катализаторы
- 3.2 Гомогенные катализаторы
- 3.3 Биологические катализаторы
- 4 Энергетика реакций
- 5 Отравление катализатора
- 6 приложений
- 7 См.
 также
также - 8 Каталожные номера
- 9 Внешние ссылки
- 10 кредитов
Катализаторы играют важную роль в биологических системах и промышленных процессах. В живых организмах ферменты катализируют многочисленные биохимические реакции, поддерживающие жизнь и участвующие в росте и репродуктивных функциях. В промышленности катализаторы используются для широкого спектра производственных процессов, включая производство аммиака, серной кислоты, полимеров и заменителей нефтепродуктов. В промышленно развитых странах, возможно, наиболее известным примером использования катализаторов является каталитический нейтрализатор, устройство, расщепляющее вредные вещества в выхлопных газах автомобилей. Исследования катализа и использования катализаторов продолжают оставаться в центре внимания многих исследователей в области естественных и прикладных наук.
В более общем смысле термин катализатор может применяться к любому агенту (включая человека или группу), который вызывает ускоренное изменение. Например, кого-то можно назвать «катализатором политических изменений».
Например, кого-то можно назвать «катализатором политических изменений».
История и этимология
Термин катализ был введен в 1835 году Йонсом Якобом Берцелиусом, который отметил, что некоторые химические вещества ускоряют реакцию. Слово происходит от греческого существительного κατάλυσις, связанного с глаголом καταλύειν, означающим «растворять», «аннулировать», «развязывать» или «подбирать».
Примерно в то же время химик Александр Мичерлих говорил о «контактных процессах», а Иоганн Вольфганг Доберейнер говорил о «контактном действии». Доберейнер работал над использованием платины в качестве катализатора и изобрел зажигалку, которая воспламенялась от воздействия водорода на платиновую губку. Эта зажигалка, названная лампой Доберейнера, имела огромный коммерческий успех в 1820-х годах.
Общий каталитический процесс
Катализатор участвует в одной или нескольких стадиях реакции, но обычно он не является реагентом или продуктом общей реакции, которую он катализирует. Исключением из этого правила является процесс, известный как автокатализ , при котором продукт реакции действует как катализатор реакции. Вещество, тормозящее действие катализатора, называется ингибитором ; тот, который ускоряет действие катализатора, называется промотором .
Исключением из этого правила является процесс, известный как автокатализ , при котором продукт реакции действует как катализатор реакции. Вещество, тормозящее действие катализатора, называется ингибитором ; тот, который ускоряет действие катализатора, называется промотором .
Катализатор может реагировать с одним или несколькими реагентами с образованием промежуточного химического вещества, и это промежуточное соединение впоследствии вступает в реакцию с образованием конечного продукта реакции. В общем процессе катализатор регенерируется. В качестве альтернативы катализатор может обеспечивать поверхность, к которой прикрепляются реагенты, облегчая их реакцию, сближая их. Образующиеся продукты высвобождаются из катализатора.
Рассмотрим следующую схему реакции, в которой C представляет катализатор, A и B — реагенты, а D — продукт реакции A и B.
- A + C → AC (1)
- B + AC → ABC (2)
- ABC → CD (3)
- CD → C + D (4)
- A + B + C → D + C
- CL • + O 3 → CLO • + O 2
- CLO • + O 3 → CL • + 2 + 2 2 → CL • 9000 + + 2 + 2 2 → CL • 9000 + + 2 + 2 3 → CL + + 2 3 → CL + + 2 3 . катализаторы
В природе ферменты являются катализаторами биохимических реакций, протекающих в живых организмах. Большинство ферментов являются белками, но некоторые ферменты, называемые рибозимами , состоят из РНК. Было обнаружено, что некоторые молекулы ДНК, называемые дезоксирибозимами , обладают каталитической активностью. Кроме того, некоторые антитела, обычно получаемые искусственно, обладают каталитической активностью и называются абзимы .
Энергетика реакций
Катализаторы обеспечивают альтернативный механизм химической реакции — механизм, который снижает энергию активации по сравнению с некаталитической реакцией.
 Это означает, что катализаторы уменьшают количество энергии, необходимой для начала химической реакции. Кроме того, «переходное состояние» (нестабильное промежуточное соединение), образующееся реагентами во время катализируемой реакции, обычно отличается от состояния, образующегося во время некаталитической реакции.
Это означает, что катализаторы уменьшают количество энергии, необходимой для начала химической реакции. Кроме того, «переходное состояние» (нестабильное промежуточное соединение), образующееся реагентами во время катализируемой реакции, обычно отличается от состояния, образующегося во время некаталитической реакции.Диаграмма энергетического профиля справа показывает, что катализируемый путь (красный) имеет более низкую энергию активации, чем некаталитический путь (синий). Кроме того, это показывает, что чистое изменение энергии для всей реакции одинаково, независимо от того, используется катализатор или нет.
Таким образом, катализаторы могут позволить реакциям протекать с гораздо большей скоростью, определенными специфическими способами или при более низких температурах. Кроме того, некоторые реакции протекают только в присутствии катализатора.
Катализаторы не могут сделать возможными энергетически невыгодные реакции. Они не оказывают никакого влияния на химическое равновесие реакции, потому что скорость прямой и обратной реакции в равной степени зависит от катализатора.

Производной единицей СИ для измерения «каталитической активности» катализатора является катал (моли в секунду). В биохимии каталитическую активность фермента измеряют в единицах фермента.
Активность катализатора также может быть описана номер оборота (Тонн). В энзимологии число оборотов определяется как максимальное количество молей субстрата, которое фермент может превратить в продукт на каталитический центр (фермента) в единицу времени. В других химических областях число оборотов (TON) определяется как количество молей субстрата, которое может преобразовать моль катализатора до того, как катализатор станет инактивированным. Термин частота оборота (TOF) используется для обозначения оборота в единицу времени, как в энзимологии.
Отравление катализатора
Катализатор может быть отравлен, если другое соединение (похожее на ингибитор) изменяет его химически или связывается с ним и не высвобождает его. Такие взаимодействия эффективно уничтожают полезность катализатора, поскольку он больше не может участвовать в реакции, которую должен был катализировать.
 Обычными каталитическими ядами являются свинец, сера, цинк, марганец и фосфор.
Обычными каталитическими ядами являются свинец, сера, цинк, марганец и фосфор.Области применения
По некоторым оценкам, 60 процентов всех промышленных химических продуктов требуют катализаторов на каком-либо этапе их производства. [2] Наиболее эффективными катализаторами обычно являются переходные металлы или комплексы переходных металлов.
Каталитический нейтрализатор автомобиля является хорошо известным примером использования катализаторов. В этом устройстве в качестве катализаторов могут использоваться платина, палладий или родий, поскольку они помогают расщеплять некоторые из наиболее вредных побочных продуктов выхлопных газов автомобилей. «Трехкомпонентный» каталитический нейтрализатор выполняет три задачи: (а) восстановление оксидов азота до азота и кислорода; б) окисление монооксида углерода до диоксида углерода; и (c) окисление несгоревших углеводородов до двуокиси углерода и воды.
Другими примерами катализаторов и их применения являются следующие.

- Обычное железо используется в качестве катализатора в процессе Габера для синтеза аммиака из азота и водорода, как упоминалось выше.
- Массовое производство полимера, такого как полиэтилен или полипропилен, катализируется агентом, известным как катализатор Циглера-Натта, который основан на хлориде титана и алкилалюминиевых соединениях.
- Оксид ванадия(V) является катализатором для производства серной кислоты в высоких концентрациях по методу, известному как процесс контакта .
- Никель используется в производстве маргарина.
- Глинозем и диоксид кремния являются катализаторами распада больших молекул углеводородов на более простые — процесс, известный как крекинг .
- Ряд ферментов используется для химических превращений органических соединений. Эти ферменты называются биокатализаторами , а их действие называется биокатализом .
- Электроды топливного элемента покрыты катализатором, таким как платина, палладий или наноразмерный порошок железа.

- Процесс Фишера-Тропша представляет собой химическую реакцию, при которой монооксид углерода и водород превращаются в жидкие углеводороды в присутствии катализаторов на основе железа и кобальта. Этот процесс в основном используется для производства синтетического заменителя нефти для топлива или смазочного масла.
- Реакции гидрирования, которые включают добавление водорода к органическим соединениям, таким как алкены или альдегиды, требуют катализатора, такого как платина, палладий, родий или рутений.
- Ряд химических реакций катализируется кислотами или основаниями.
См. также
- Катализ
- Ферменты
Ссылки
Ссылки ISBN поддерживают NWE за счет реферальных сборов
- ↑ Обратите внимание, что термин «адсорбция» означает связывание с поверхностью вещества. В этом случае реагенты связываются с поверхностью катализатора.
- ↑ «Признание лучших в инновациях: катализатор прорыва», R&D Magazine , сентябрь 2005 г.
 , стр. 20.
, стр. 20.
Внешние ссылки
Все ссылки получены 17 января 2017 г.
- Презентация W.A. Herrmann Technische Universität
Кредиты
Энциклопедия Нового Света авторы и редакторы переписали и дополнили статью Википедии
в соответствии со стандартами New World Encyclopedia . Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3.0 (CC-by-sa), которая может использоваться и распространяться с надлежащим указанием авторства. Кредит должен соответствовать условиям этой лицензии, которая может ссылаться как на Энциклопедия Нового Света участников и самоотверженных добровольных участников Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних вкладов википедистов доступна исследователям здесь:- Катализатор История
- Катализ история
- Catalytic_converter история
- Turn_over_number история
История этой статьи с момента ее импорта в New World Encyclopedia :
- История «Catalyst»
Примечание.
 На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.Катализатор и скорость реакции | Глава 6: Химические изменения
Тебе это нравится? Не нравится ? Пожалуйста, найдите время, чтобы поделиться с нами своими отзывами. Спасибо!
Урок 6.5
Ключевые понятия
- Катализатор — это вещество, которое помогает реагентам в химической реакции реагировать друг с другом быстрее.
- Катализатор фактически не становится частью продуктов реакции.
Резюме
Учащиеся смотрят видео и выполняют быстрое задание, чтобы увидеть, что катализатор может увеличить скорость распада (разложения) перекиси водорода. Затем учащиеся будут использовать соль в качестве катализатора реакции между алюминиевой фольгой и раствором сульфата меди II. Студенты познакомятся с концепцией, согласно которой катализатор увеличивает скорость химической реакции, но не включается в продукты реакции.

Задача
Учащиеся смогут определить катализатор как вещество, которое увеличивает скорость химической реакции, но не входит в состав продуктов реакции.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и учащиеся носите подходящие защитные очки. При использовании перекиси водорода следуйте всем предупреждениям на этикетке. После того, как учащиеся выполнили задание с раствором сульфата меди II и алюминиевой фольгой, дайте содержимому чашки испариться. Поместите небольшое количество твердого вещества в бумажное полотенце и выбросьте в мусорное ведро или используйте метод утилизации, требуемый местным законодательством.
Материалы для каждой группы
- Градуированный цилиндр (50 мл или 100 мл)
- Перекись водорода (3%)
- Дрожжи
- 2 палочки для эскимо
- Моющий раствор
- Пипетка
- Маленькая чашка
- Прозрачный пластиковый стаканчик
- Раствор сульфата меди II (в чашке)
- Соль
- Алюминиевая фольга (5 см × 5 см)
- Термометр
Примечания о материалах
Сульфат меди II можно приобрести у различных поставщиков химикатов, включая Sargent Welch, номер продукта WLC94770-06, или Flinn Scientific, номер продукта C0110.

Покажите учащимся две демонстрации и попросите их найти доказательства того, что в результате химических реакций образуется газ.
Скажите учащимся, что вы покажете им видеозапись двух демонстраций, в которых водяной пар и газообразный кислород образуются в результате одной и той же химической реакции. Поскольку газы невидимы, попросите студентов внимательно следить за доказательствами образования газа.
Спроецируйте видео «Зубная паста слона».
Вспенивание показывает, что газы (кислород и водяной пар) образуются очень быстро. Количество пены, образующейся за определенный период времени, является способом измерения скорости реакции.
Проецируйте видео «Джинн в бутылке».
Пар, выходящий из бутылки, представляет собой водяной пар, который конденсируется на выходе из бутылки. Кислород тоже выходит из баллона, но его не видно.
Спросите студентов:
- Как определить, что в результате химической реакции образуется газ?
- Вспенивание зубной пасты для слонов означает, что выделяется газ.
 Выделение газа является признаком того, что произошла химическая реакция. Водяной пар в демонстрации джинна в бутылке также показывает производство газа.
Выделение газа является признаком того, что произошла химическая реакция. Водяной пар в демонстрации джинна в бутылке также показывает производство газа.
Скажите ученикам, что этот урок посвящен ускорению химических реакций. Некоторые реакции протекают очень медленно, но можно добавить химические вещества, называемые катализаторами, чтобы ускорить их. Обе эти демонстрации опирались на катализатор.
Опишите, как при разложении перекиси водорода образуется газообразный кислород в обоих видеороликах.
Сообщите учащимся, что в обеих демонстрациях используется 30-процентный раствор перекиси водорода. Обычно перекись водорода, которую вы можете купить в магазине, содержит только 3% перекиси водорода. Объясните учащимся, что химическая формула перекиси водорода: H 2 O 2 . Укажите, что перекись водорода не очень стабильна и сама по себе распадается на воду и кислород. Такое изменение представляет собой химическую реакцию, называемую разложением.
 Разложение перекиси водорода происходит медленно и обычно незаметно.
Разложение перекиси водорода происходит медленно и обычно незаметно.Спроектируйте изображение Разложение перекиси водорода.
Объясните, что перекись водорода разлагается с образованием воды и кислорода в соответствии с этим химическим уравнением:
Скажите учащимся, что эта химическая реакция происходит сама по себе и что даже энергия света в комнате может ускорить разложение перекиси водорода. Вот почему перекись водорода продается в непрозрачных контейнерах.
Скажите учащимся, что в видеоролике вещество (перманганат калия или двуокись марганца) использовалось для ускорения разложения перекиси водорода. Несмотря на то, что это ускорило реакцию, само вещество не изменилось во время реакции. Вещество, увеличивающее скорость реакции, но не входящее в состав продуктов реакции, называется катализатором.
Спросите студентов:
- Ваш учитель показал вам демонстрацию, где к перекиси водорода добавляется катализатор, и образуется большое количество газообразного кислорода.
 Если катализатор участвует в химической реакции, то почему он не включен в химическое уравнение как продукт?
Если катализатор участвует в химической реакции, то почему он не включен в химическое уравнение как продукт? - Катализатор не попадает в продукты, поэтому не включается в химическую реакцию.
- Что делает катализатор в химической реакции?
- Катализаторы ускоряют реакцию, но не меняются в ходе реакции.
Дайте каждому учащемуся рабочий лист.
Учащиеся записывают свои наблюдения и отвечают на вопросы о задании в листе задания. Разделы «Объясните это с помощью атомов и молекул» и «Возьми это» Дальнейшие разделы рабочего листа будут выполняться в классе, в группах или индивидуально, в зависимости от ваших инструкций. Посмотрите на версию листа с заданиями для учителя, чтобы найти вопросы и ответы.
- Ваш учитель показал вам демонстрацию, где к перекиси водорода добавляется катализатор, и образуется большое количество газообразного кислорода.
Предложите учащимся использовать дрожжи для катализа разложения перекиси водорода.
Вопрос для расследования
Может ли другое вещество катализировать разложение перекиси водорода?
Материалы для каждой группы
- Градуированный цилиндр
- Перекись водорода (3%)
- Дрожжи
- Палочка для эскимо
- Моющий раствор
- Пипетка
Подготовка учителя
Приготовьте раствор моющего средства, добавив 1 чайную ложку жидкого моющего средства для посуды на 2 столовые ложки воды.
 Разделите этот раствор моющего средства поровну на одну маленькую чашку для каждой группы.
Разделите этот раствор моющего средства поровну на одну маленькую чашку для каждой группы.Процедура
Добавьте 10 мл перекиси водорода в мерный цилиндр. Добавьте 1 каплю раствора моющего средства. Осторожно встряхните и наблюдайте за раствором на наличие пузырьков.
Объясните учащимся, что моющее средство добавляется только для образования пузырей в случае образования газа. Поскольку при распаде перекиси водорода образуется газообразный кислород, появление пузырьков указывает на то, что перекись водорода разрушается или разлагается. Отсутствие пузырьков свидетельствует о том, что вырабатывается не так много газообразного кислорода.
Используйте конец палочки от эскимо, чтобы добавить небольшое количество дрожжей в перекись водорода в градуированном цилиндре и взболтать.
- Положите градуированный цилиндр на стол и следите за появлением пузырьков.
- Держите градуированный цилиндр, чтобы увидеть, есть ли какие-либо изменения в температуре.

Ожидаемые результаты
До добавления дрожжей пузырьков не наблюдается. После добавления дрожжей пузырьки заставят пену двигаться вверх по градуированному цилиндру. Кроме того, градуированный цилиндр должен быть немного теплее, потому что при разложении перекиси водорода выделяется энергия. Изменения энергии в химических реакциях будут более подробно исследованы в главе 6, уроке 7.
Обсудите наблюдения учеников.
Спросите студентов:
- Какие у вас есть признаки того, что в этом упражнении произошла химическая реакция?
- Пузырьки. Скажите учащимся, что изменение температуры также является признаком возможной химической реакции. Эндотермические и экзотермические химические реакции будут рассмотрены в главе 6, уроке 7.
- Что является катализатором в этой деятельности?
- Вещество в дрожжах.
- Какие у вас есть доказательства того, что перекись водорода быстрее разлагается при добавлении дрожжей?
- После добавления дрожжей образовались пузырьки газообразного кислорода.

- Когда вы пишете химическое уравнение для этой реакции, должны ли дрожжи включаться в химическое уравнение в качестве продукта?
- Объясните учащимся, что катализатор в дрожжах не попадает в продукты, а является веществом, ускоряющим разложение. Иногда катализатор пишут над или под стрелкой в химическом уравнении, но он никогда не включается в состав реагентов или продуктов.
Как правило, катализаторы работают, создавая место, где реагенты могут собираться вместе для реакции. Объясните учащимся, что клетки дрожжей и других организмов содержат катализатор под названием каталаза . Благодаря нормальным клеточным процессам живые существа производят перекись водорода в своих клетках. Но перекись водорода — это яд, поэтому клеткам нужен способ очень быстро его расщепить. В клетках содержится каталаза, которая очень быстро расщепляет перекись водорода. Каждую секунду одна молекула каталазы может катализировать расщепление миллионов молекул перекиси водорода.

Студенты могут продолжить изучение влияния каталазы на перекись водорода, добавив кусочек сырого свежего картофеля в небольшое количество перекиси водорода.
Предложите учащимся назвать изменения, происходящие при взаимодействии сульфата меди II с кусочком алюминиевой фольги.
Примечание: это реакция между сульфатом меди II и алюминием. Медь называется «медь II», потому что медь может образовывать различные типы ионов. Он может потерять один электрон и быть просто Cu + или он может потерять два электрона и быть Cu 2+ . Этот тип иона меди называется медью II. Также «сульфат» в сульфате меди II также является ионом. Этот ион состоит из более чем одного атома. Это один из многоатомных ионов, обсуждавшихся в главе 4, уроке 3. Ион сульфата состоит из атома серы, связанного с четырьмя атомами кислорода, и рассматривается как один ион (SO 4 2− ).
Есть несколько интересных аспектов реакции между сульфатом меди II и алюминием, но она отличается от других реакций, с которыми до сих пор сталкивались учащиеся.
 В этой реакции движение электронов, а не целых атомов, ионов или молекул вызывает реакцию. Этот тип реакции называется реакцией окисления/восстановления. Эту конкретную реакцию интересно проводить, потому что она экзотермическая, генерирует газ, и металлическая медь появляется, когда металлический алюминий исчезает.
В этой реакции движение электронов, а не целых атомов, ионов или молекул вызывает реакцию. Этот тип реакции называется реакцией окисления/восстановления. Эту конкретную реакцию интересно проводить, потому что она экзотермическая, генерирует газ, и металлическая медь появляется, когда металлический алюминий исчезает.Соль можно считать катализатором реакции, но она играет иную роль, чем большинство катализаторов. Сульфат меди II и алюминий реагируют очень медленно, потому что алюминий покрыт очень тонким слоем потускнения (оксид алюминия). Эту реакцию можно ускорить, если удалить или повредить слой оксида алюминия. Добавление соли делает это и позволяет электронам алюминия реагировать с ионами меди в растворе, превращая их в металлическую медь.
Вопрос для расследования
Что является катализатором в следующем упражнении?
Материалы для каждой группы
- Раствор сульфата меди II (в чашке)
- Прозрачный пластиковый стаканчик (пустой)
- Соль
- Кусок алюминиевой фольги
- Термометр
- Палочка для эскимо
Подготовка учителя
Приготовьте раствор сульфата меди II, добавив 20 г сульфата меди II в 200 мл воды.
 Налейте около 25 мл раствора сульфата меди II в чашку для каждой группы. Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину).
Налейте около 25 мл раствора сульфата меди II в чашку для каждой группы. Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину).Процедура
- Поместите кусок алюминиевой фольги в пустую чашку. Пальцами или палочкой от мороженого плотно прижмите фольгу, чтобы она лежала ровно и закрывала дно чашки.
- Добавьте весь раствор сульфата меди II в чашку с алюминиевой фольгой.
- Аккуратно взболтайте раствор в течение нескольких секунд и дайте ему постоять. Следите за алюминием на наличие пузырей или изменения цвета.
Используйте палочку от эскимо, чтобы поместить небольшое количество соли в раствор сульфата меди II. Аккуратно взболтайте раствор в течение нескольких секунд и дайте ему постоять. Следите за появлением пузырьков или изменением цвета.
- Осторожно поместите термометр в чашку и посмотрите, изменится ли температура.
Ожидаемые результаты
До добавления соли пузырьки и изменение цвета отсутствуют.
 После добавления соли цвет становится зеленоватым, и на алюминии начинают образовываться пузыри. Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.
После добавления соли цвет становится зеленоватым, и на алюминии начинают образовываться пузыри. Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.Обсудите наблюдения учеников.
Спросите студентов:
- Откуда вы знаете, что при помещении куска алюминиевой фольги и хлорида натрия в раствор сульфата меди II происходит химическая реакция?
- Возникло пузырение, изменение цвета, повышение температуры и образование другого твердого вещества.
- Что является катализатором в этой деятельности?
- Соль.
- Чем добавление соли к алюминию похоже на добавление дрожжей к перекиси водорода?
- Оба могут рассматриваться как катализаторы. Добавление дрожжей помогает перекиси водорода быстрее разлагаться, а добавление соли помогает алюминию реагировать с сульфатом меди II.

катализатор (С) расходуется реакцией на первой стадии, но регенерируется на четвертой стадии. Таким образом, общую реакцию можно записать в виде:
Таким образом, общую реакцию можно записать в виде:
Типы катализаторов
Катализаторы могут быть гетерогенными или гомогенными. Биологические катализаторы (или биокатализаторы) часто выделяют в отдельную группу.
Гетерогенный катализатор — это катализатор, находящийся в фазе, отличной от фазы реагентов. Например, твердый катализатор можно использовать в жидкой реакционной смеси. С другой стороны, гомогенный катализатор находится в той же фазе, что и реагенты. Например, катализатор может быть растворен в жидкой реакционной смеси.
Гетерогенные катализаторы
Простая модель гетерогенного катализа включает катализатор, создающий поверхность, на которой реагенты (или субстраты) временно адсорбируются. [1] Химические связи в субстрате становятся достаточно ослабленными для создания новых связей. По мере образования продуктов они относительно слабо связываются с катализатором и поэтому высвобождаются. Известны различные возможные механизмы реакций на поверхности в зависимости от того, как происходит адсорбция.
Известны различные возможные механизмы реакций на поверхности в зависимости от того, как происходит адсорбция.
Например, рассмотрим процесс Габера для производства аммиака из азота и водорода. В этом случае мелкодисперсное железо выступает в роли гетерогенного катализатора. Поскольку молекулы реагентов (водорода и азота) связываются с катализатором, этот процесс связывания имеет два эффекта: во-первых, молекулы сближаются ближе, чем они были бы в газовой фазе; во-вторых, их внутренние связи ослабевают. Таким образом, катализатор позволяет молекулам реагентов реагировать быстрее, чем если бы они оставались в газовой фазе.
Гомогенные катализаторы
При гомогенном катализе сам катализатор может трансформироваться на ранней стадии реакции и регенерироваться к концу реакции. Примером может служить расщепление озона свободными радикалами хлора (свободными атомами хлора). Свободные радикалы хлора образуются при воздействии ультрафиолетового излучения на хлорфторуглероды (ХФУ). Эти свободные радикалы реагируют с озоном с образованием молекул кислорода, а свободные радикалы хлора регенерируются. Ниже приведены некоторые из простейших реакций.
Эти свободные радикалы реагируют с озоном с образованием молекул кислорода, а свободные радикалы хлора регенерируются. Ниже приведены некоторые из простейших реакций.

 также
также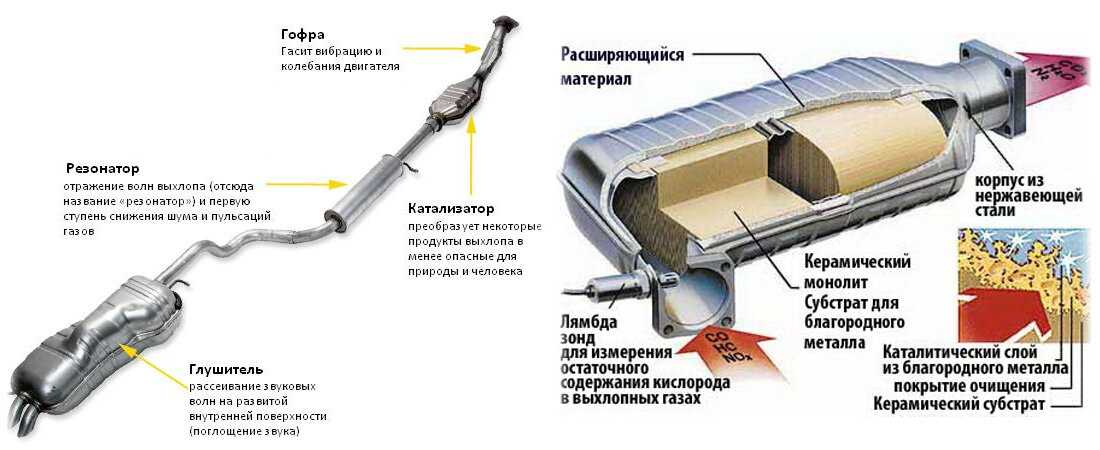 Это означает, что катализаторы уменьшают количество энергии, необходимой для начала химической реакции. Кроме того, «переходное состояние» (нестабильное промежуточное соединение), образующееся реагентами во время катализируемой реакции, обычно отличается от состояния, образующегося во время некаталитической реакции.
Это означает, что катализаторы уменьшают количество энергии, необходимой для начала химической реакции. Кроме того, «переходное состояние» (нестабильное промежуточное соединение), образующееся реагентами во время катализируемой реакции, обычно отличается от состояния, образующегося во время некаталитической реакции.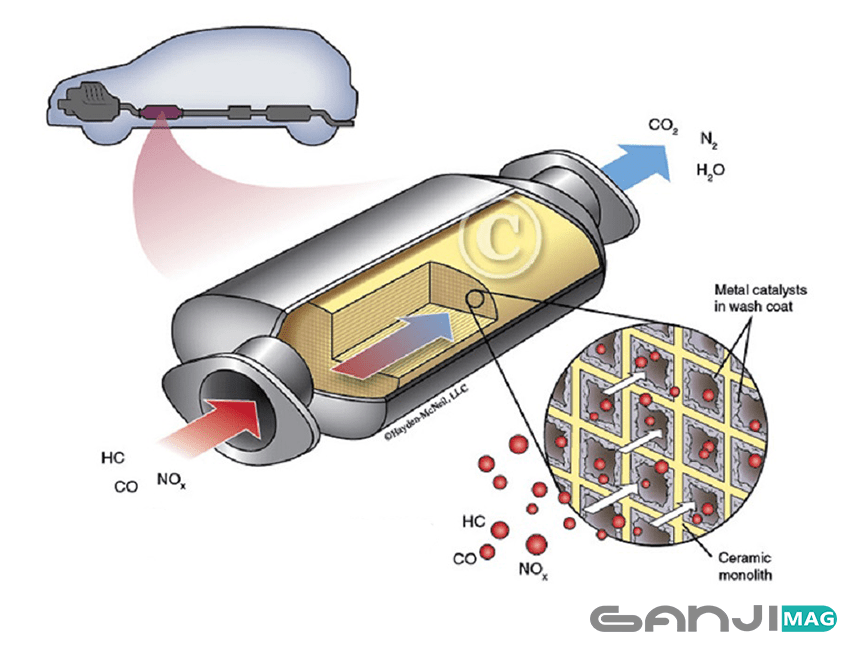
 Обычными каталитическими ядами являются свинец, сера, цинк, марганец и фосфор.
Обычными каталитическими ядами являются свинец, сера, цинк, марганец и фосфор.
 , стр. 20.
, стр. 20. На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.
На использование отдельных изображений, лицензированных отдельно, могут распространяться некоторые ограничения.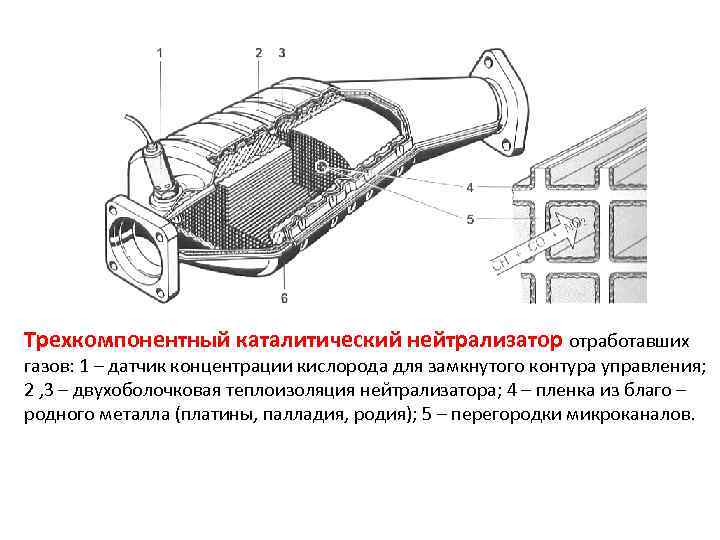

 Выделение газа является признаком того, что произошла химическая реакция. Водяной пар в демонстрации джинна в бутылке также показывает производство газа.
Выделение газа является признаком того, что произошла химическая реакция. Водяной пар в демонстрации джинна в бутылке также показывает производство газа. Разложение перекиси водорода происходит медленно и обычно незаметно.
Разложение перекиси водорода происходит медленно и обычно незаметно.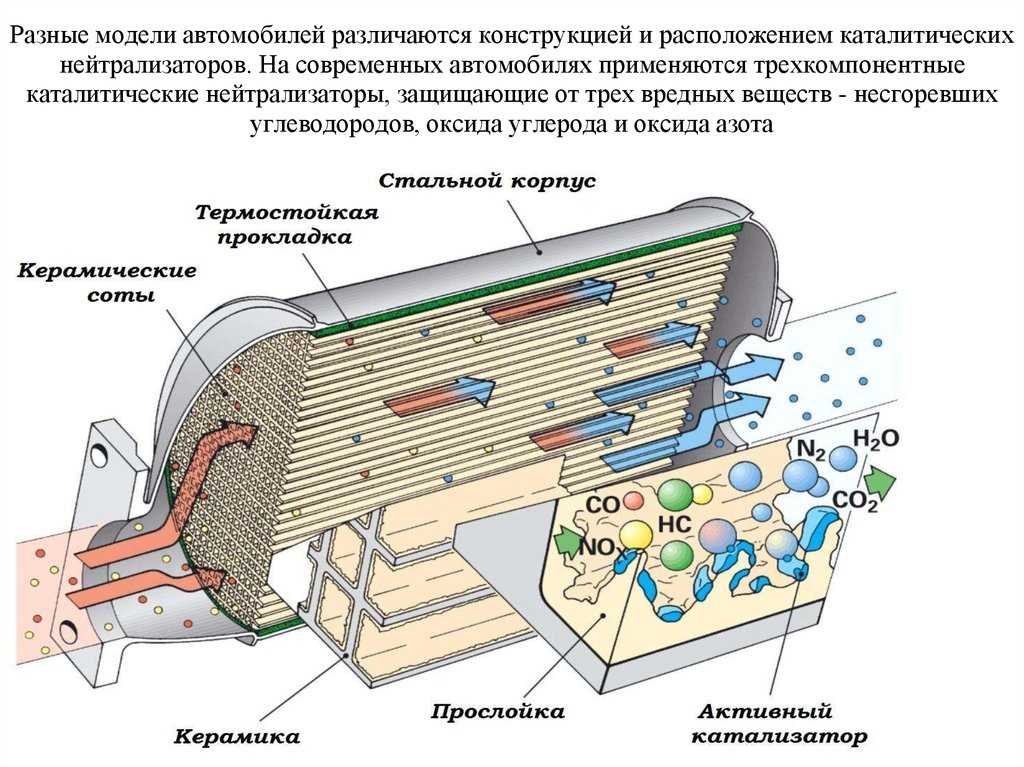 Если катализатор участвует в химической реакции, то почему он не включен в химическое уравнение как продукт?
Если катализатор участвует в химической реакции, то почему он не включен в химическое уравнение как продукт? Разделите этот раствор моющего средства поровну на одну маленькую чашку для каждой группы.
Разделите этот раствор моющего средства поровну на одну маленькую чашку для каждой группы.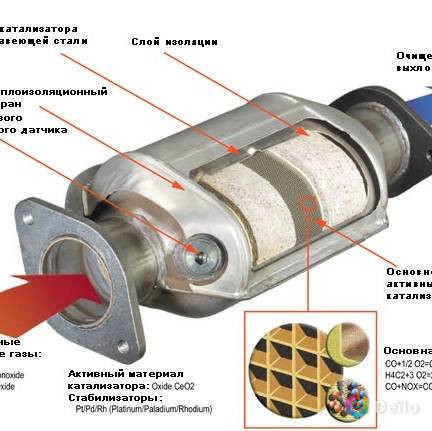

 В этой реакции движение электронов, а не целых атомов, ионов или молекул вызывает реакцию. Этот тип реакции называется реакцией окисления/восстановления. Эту конкретную реакцию интересно проводить, потому что она экзотермическая, генерирует газ, и металлическая медь появляется, когда металлический алюминий исчезает.
В этой реакции движение электронов, а не целых атомов, ионов или молекул вызывает реакцию. Этот тип реакции называется реакцией окисления/восстановления. Эту конкретную реакцию интересно проводить, потому что она экзотермическая, генерирует газ, и металлическая медь появляется, когда металлический алюминий исчезает. Налейте около 25 мл раствора сульфата меди II в чашку для каждой группы. Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину).
Налейте около 25 мл раствора сульфата меди II в чашку для каждой группы. Нарежьте алюминиевую фольгу на куски, достаточные для покрытия дна чашки (примерно 5 см в длину и 5 см в ширину). После добавления соли цвет становится зеленоватым, и на алюминии начинают образовываться пузыри. Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.
После добавления соли цвет становится зеленоватым, и на алюминии начинают образовываться пузыри. Вскоре на алюминии начинает образовываться коричневатый материал (медь). Пузырение становится более сильным, и раствор теряет свой синий цвет по мере того, как исчезает алюминий и образуется больше меди. Раствор также нагревается.