Содержание
Принцип работы свинцово-кислотного аккумулятора.
Принцип работы свинцового аккумулятора
Источником электроэнергии на автомобиле при неработающем или работающем с малой частотой вращения коленчатого вала двигателе является аккумуляторная батарея. В настоящее время на автомобилях наиболее широко применяются свинцовые аккумуляторные батареи, состоящие из нескольких последовательно соединенных аккумуляторов. Применение кислотных аккумуляторов объясняется тем, что они обладают небольшим внутренним сопротивлением и способны в течение короткого промежутка времени (несколько секунд) отдавать ток силой в несколько сотен ампер, что необходимо для питания стартера при пуске двигателя.
Свинцовый аккумулятор электрической энергии был изобретен в 1859 году французским физиком Гастоном Планте. В последующие годы конструкция аккумулятора, особенно – химический состав его электродов (пластин) постоянно совершенствовалась. В настоящее время свинцовые аккумуляторы и аккумуляторные батареи широко применяются в разных областях техники в качестве накопителей электроэнергии (стартерные батареи, аварийные и резервные источники энергии и т. п.).
В настоящее время свинцовые аккумуляторы и аккумуляторные батареи широко применяются в разных областях техники в качестве накопителей электроэнергии (стартерные батареи, аварийные и резервные источники энергии и т. п.).
Конструктивно аккумулятор представляет собой емкость, наполненную электролитом, в которой размещены свинцовые электроды. В качестве электролита используется раствор серной кислоты и дистиллированной воды. Электроды выполнены в виде пластин, одна из которых изготовлена из губчатого свинца Pb, а вторая – из диоксида свинца PbO2. При взаимодействии электродов с электролитом между ними возникает разность потенциалов.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в водном растворе серной кислоты.
При подключении к электродам аккумулятора внешней нагрузки начинается электрохимическая реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца.
Во время разряда происходит восстановление диоксида свинца на положительном электроде (аноде) и окисление свинца на отрицательном электроде (катоде). При пропускании через электроды аккумулятора зарядного тока в нем протекают обратные реакции. При перезаряде аккумулятора, после исчерпания сульфата свинца начинается электролиз воды, при этом на аноде выделяется кислород, а на катоде — водород.
Электрохимические реакции (слева направо — при разряде, справа налево — при заряде):
Реакции на аноде:
PbO2 + SO42- + 4H+ + 2e— ↔ PbSO4 + 2H2O;
Реакции на катоде:
Pb + SO42- — 2e— ↔ PbSO4.
Физические процессы, происходящие в аккумуляторе, объясняются свойством электролитического растворения металлов, которое заключается в переходе положительно заряженных ионов металла в раствор. Легкоокисляющиеся металлы (например, свинец) обладают этим свойством в большей степени, чем инертные металлы.
При погружении свинцового электрода в раствор электролита от него начнут отделяться положительно заряженные ионы свинца и переходить в раствор, при этом сам электрод будет заряжаться отрицательно.
По мере протекания процесса растет разность потенциалов раствора и электрода, и переход положительных ионов в раствор будет замедляться.
При какой-то определенной разности потенциалов электрода и раствора наступит равновесие между силой электролитической упругости растворения свинца, с одной стороны, и силами электростатического поля и осмотического давления — с другой.
В результате переход ионов свинца в электролит прекратится.
При погружении электрода, изготовленного из двуокиси свинца, в раствор серной кислоты наблюдается такой же процесс, но результат получается иной. Двуокись свинца в ограниченном количестве переходит в раствор, где при соединении с водой ионизируется на четырехвалентные ионы свинца Рв4+ и одновалентные ионы гидроксила ОН.
Четырехвалентные ионы свинца, осаждаясь на электроде, создают положительный потенциал относительно раствора. Серная кислота образует в воде практически только на ионы НO+ и HSO4.
Таким образом, при разряде аккумулятора расходуется серная кислота, образуется вода, а на обоих электродах — сульфат свинца. При заряде процессы протекают в обратном направлении.
При подключении потребителей в аккумуляторе возникает разрядный ток. При этом ионы сернокислотного остатка SO4 соединяются со свинцом электродов и образуют на них сернокислый свинец PbSO4, а ионы водорода соединяются с кислородом, выделяясь на положительной пластине в виде воды.
В результате электроды покрываются сернокислым свинцом, а серная кислота разбавляется водой, т. е. при разряде аккумулятора плотность электролита уменьшается. Поэтому по плотности электролита можно судить о степени заряженности аккумуляторной батареи.
При прохождении электрического (зарядного) тока через аккумуляторную батарею протекают обратные электрохимические процессы. Ионы водорода, образующиеся в результате распада воды, взаимодействуют с сернокислым свинцом электродов.
Водород, соединяясь с сернистым осадком, образует серную кислоту, а на электродах восстанавливается губчатый свинец. Выделяющийся из воды кислород, соединяется со свинцом положительной пластины, образуя перекись свинца.
В результате этих процессов содержание воды в электролите уменьшается, а содержание кислоты увеличивается, что приводит к повышению плотности электролита.
По завершению процессов восстановления свинца на электродах заряд аккумулятора прекращается. При дальнейшем прохождении электрического тока через электролит начинается процесс электролиза (разложения) воды, при этом аккумулятор «закипает», и выделяющиеся пузырьки образуют смесь водорода и кислорода. Смесь этих газов является взрывоопасной, поэтому следует избегать перезаряда до появления электролизных явлений по разложению воды.
Кроме того, длительный перезаряд приводит к потере электролитом воды (испарению), в результате чего его плотность повышается и для корректировки требуется доливка дистиллированной воды.
При доливке воды необходимо помнить, что вода, попадающая в концентрированную серную кислоту, закипает и сильно разбрызгивает кислотные капли, что при попадании на открытое тело или одежду может привести к ожогам кожи, слизистых оболочек, прожигу одежды и другим неприятным последствиям.
При постоянном напряжении источника зарядного тока по мере увеличения степени заряженности аккумулятора повышается его ЭДС и, следовательно, уменьшается сила зарядного тока. Когда напряжение на клеммах источника тока будет равно ЭДС полностью заряженного аккумулятора плюс ЭДС поляризации, зарядный ток прекратится.
Среднее значение напряжения аккумулятора – 2 В. Поскольку электрооборудование современных автомобилей рассчитано для работы при напряжении в бортовой сети 12 или 24 В, аккумуляторы соединяют в батареи (по 6 или 12 шт. ).
).
Важным параметром аккумулятора является его емкость, т. е. количество электрической энергии, которую способен отдать аккумулятор. Емкость – это произведение силы разрядного тока на продолжительность разрядки до предельно допустимого разряженного состояния. Измеряется емкость аккумулятора в ампер-часах (А×ч). Емкость аккумулятора зависит, в первую очередь, от активной площади его электродов.
Поэтому повышения емкости можно достичь увеличением поверхности электродов, что достигается использованием нескольких параллельно соединенных между собой пластин, а также применением пористого материала для их изготовления, что позволяет использовать в качестве активной массы не только поверхность, но и внутренний объем пластин.
Емкость аккумулятора не постоянна, она зависит от силы разрядного тока, температуры электролита и состояния активной поверхности пластин. При увеличении разрядного тока и понижении температуры электролита емкость аккумулятора уменьшается, что объясняется неполным протеканием электрохимических реакций разрядки в этих условиях, вследствие сокращения времени разрядки и повышения вязкости электролита при низких температурах.
***
Устройство аккумуляторной батареи и ее маркировка
Главная страница
- Страничка абитуриента
Дистанционное образование
- Группа ТО-81
- Группа М-81
- Группа ТО-71
Специальности
- Ветеринария
- Механизация сельского хозяйства
- Коммерция
- Техническое обслуживание и ремонт автотранспорта
Учебные дисциплины
- Инженерная графика
- МДК.01.01. «Устройство автомобилей»
- Карта раздела
- Общее устройство автомобиля
- Автомобильный двигатель
- Трансмиссия автомобиля
- Рулевое управление
- Тормозная система
- Подвеска
- Колеса
- Кузов
- Электрооборудование автомобиля
- Основы теории автомобиля
- Основы технической диагностики
- Основы гидравлики и теплотехники
- Метрология и стандартизация
- Сельскохозяйственные машины
- Основы агрономии
- Перевозка опасных грузов
- Материаловедение
- Менеджмент
- Техническая механика
- Советы дипломнику
Олимпиады и тесты
- «Инженерная графика»
- «Техническая механика»
- «Двигатель и его системы»
- «Шасси автомобиля»
- «Электрооборудование автомобиля»
Принцип действия аккумулятора | Аккумуляторные батареи
- Подробности
- Категория: Оборудование
- эксплуатация
- ремонт
- хранение энергии
Содержание материала
- Аккумуляторные батареи
- Электрические характеристики аккумуляторных батарей
- Принцип действия аккумулятора
- Свинцово-кислотные аккумуляторы
- Пластины аккумуляторов
- Сепараторы для свинцово-кислотных аккумуляторов
- Сосуды для свинцово-кислотных аккумуляторов
- Сборка для свинцово-кислотных аккумуляторов
- Железо–никелевые аккумуляторы
- Никель-кадмиевые аккумуляторы
- Серебряно-цинковые аккумуляторы
- Электролит для свинцовых аккумуляторов
- Свойства щелочных электролитов
- Приготовление электролита
- Источники повреждений аккумуляторных батарей
- Заряд аккумуляторных батарей
- Зарядные устройства
- Ремонт аккумуляторных батарей
- Оборудование мастерской по ремонту аккумуляторных батарей
- Ремонт
- Сборка аккумуляторных батарей
- Охрана труда и техника безопасности
- Особенности эксплуатации аккумуляторных батарей на электростанциях и подстанциях
- Основные сведения по монтажу
- Порядок эксплуатации аккумуляторных батарей
- Техническое обслуживание аккумуляторных батарей
Страница 3 из 26
1. 4. Принцип действия аккумулятора
4. Принцип действия аккумулятора
В настоящее время выпускаются следующие типы электрических аккумуляторов: свинцово-кислотные, щелочные железо-никелевые, кадмий-никелевые и серебряно-цинковые аккумуляторы.
Наиболее массовыми типами аккумуляторов являются свинцово-кислотные автомобильные батареи и тяговые щелочные железо-никелевые аккумуляторы. Серебряно-цинковые аккумуляторы находят ограниченное применение из-за дороговизны и дефицитности исходных материалов и сравнительно малого срока службы.
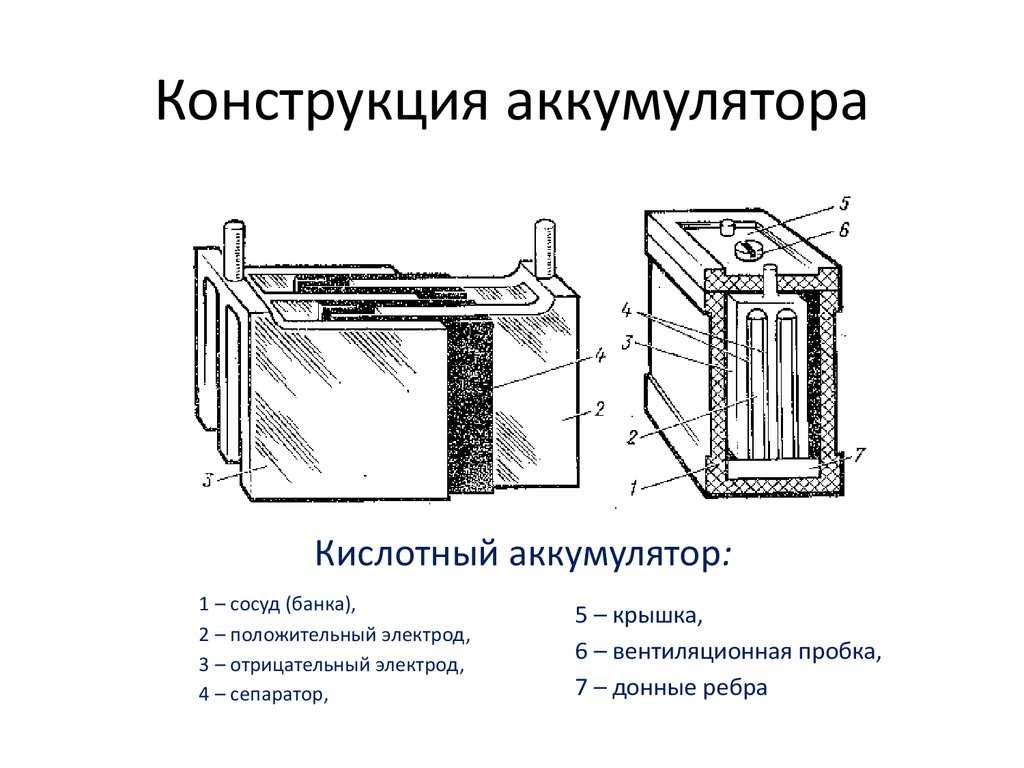
Кислотные аккумуляторы представляют собой сосуд, заполненный электролитом соответствующей плотности, т. е. раствором серной кислоты h3SO4 в дистиллированной воде, в который погружен блок пластин из чистого свинца РЬ и блок пластин из перекиси свинца РЬО2 (рис. 1.7). Вследствие постоянно происходящей диссоциации молекул кислоты в электролите заряженного аккумулятора имеются ионы водорода Н2 (катионы) и ионы кислотного остатка SO4 (анионы). Если пластины аккумулятора замкнуть на некоторое сопротивление, то через него потечет ток. Отрицательно заряженные ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято называть отрицательными, а из двуокиси свинца – положительными.
Отрицательно заряженные ионы SO4 будут стремиться к пластинам из чистого свинца, заряженным положительно. Ионы водорода, имеющие положительный заряд, будут стремиться к отрицательным пластинам, содержащим двуокись свинца. Пластины из свинца принято называть отрицательными, а из двуокиси свинца – положительными.
При разрядке кислотного аккумулятора происходят следующие химические реакции:
у отрицательной пластины
Pb + SO4 = PbS04;
у положительной пластины
РЬО2 + h3+h3SO4=PbSO4+2h3O.
Рис. 1.7. Устройство и принцип действия кислотного аккумулятора.
Из рассмотренных химических реакций видно, что при разрядке кислотных аккумуляторов на всех пластинах выделяется сернокислый свинец PbSO4 и уменьшается концентрация электролита (вследствие диссоциации кислоты и выделения воды).
Сернокислый свинец обладает двумя недостатками. Во-первых, при интенсивном образовании сернокислого свинца возможно коробление или выпучивание пластин, а также «высыпание» из пластин активной массы, так как объем сернокислого свинца больше объема исходных продуктов, из которых он образуется.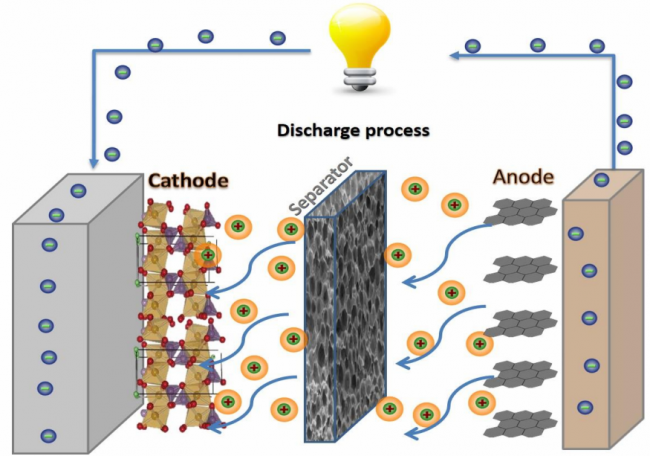 Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора.
Во-вторых, сернокислый свинец по истечении некоторого времени кристаллизуется в нерастворимое вещество. Часть пластины, которая оказалась покрытой кристаллизовавшимся сернокислым свинцом, не участвует в химических реакциях. Вследствие этого снижается полезная емкость аккумулятора. Такое явление носит название сульфатации кислотных аккумуляторов. Для того чтобы избежать явления сульфатации, кислотные аккумуляторы не следует хранить в незаряженном состоянии, нельзя допускать недозарядку аккумуляторов. При коротком замыкании в результате бурной химической реакции и интенсивного выделения сернокислого свинца происходит коробление пластин кислотного аккумулятора.
Зарядка аккумуляторов производится от внешнего источника электроэнергии, генератора постоянного тока или выпрямителя. При зарядке к отрицательным пластинам направляются ионы водорода, а к положительным — ионы кислотного остатка. В результате возникают следующие химические реакции:
у отрицательной пластины
PbS04 + h3 = Pb + h3S04;
у положительной пластины
PbS04 + 2 Н20 + S04 = Рb02 + 2 Н2 + 2 h3SO4.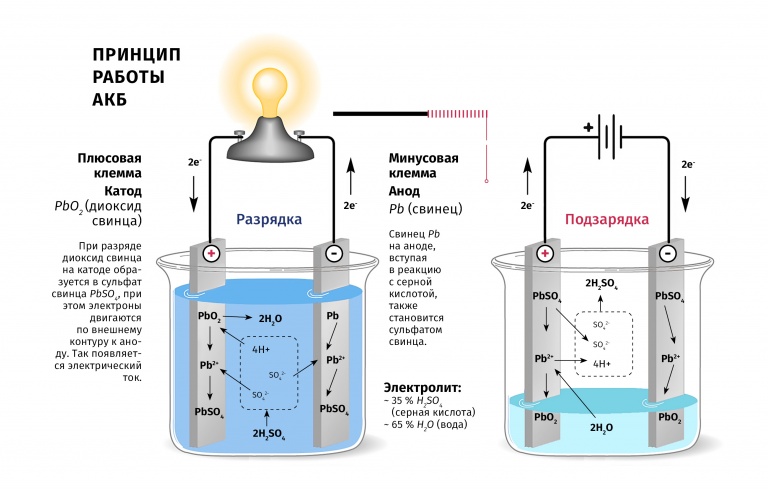
Следовательно, при зарядке аккумуляторов происходит разложение сернокислого свинца на исходные продукты, а также восстановление концентрации электролита. Очевидно, что окончанием зарядки аккумуляторов можно считать такой момент, когда весь сернокислый свинец разложился и концентрация электролита восстановилась до нормальной. При дальнейшей зарядке потребляемая аккумулятором электрическая энергия будет расходоваться на разложение воды, имеющейся в электролите. Вода разлагается на водород и кислород. Кислород, как наиболее активный газ, производит окисление металлов, имеющихся в аккумуляторе. Водород выделяется в атмосферу. Поэтому на поверхности электролита появляются пузырьки, создающие впечатление «кипения» электролита. В смеси с воздухом водород образует взрывчатый гремучий газ, который должен быть немедленно удален из аккумуляторного помещения.
ЭДС не включенного на разрядку кислотного аккумулятора, принимается в среднем равной 2,1 В независимо от размеров аккумулятора.
Напряжение, создаваемое аккумулятором на зажимах, определяется уравнениями:
при разрядке
U = E-IPr;
при зарядке
U=E+Iзар r
где Е – ЭДС аккумулятора;
Ip,Iзар – соответственно ток разрядки и зарядки аккумулятора;
r – внутреннее сопротивление аккумулятора.
Кислотные аккумуляторы имеют небольшое внутреннее сопротивление, поэтому напряжение на зажимах аккумулятора незначительно снижается даже при больших токах нагрузки. В среднем сопротивление кислотного аккумулятора составляет 0,005 Ом и является величиной, зависящей от плотности электролита, а также от габаритов аккумуляторов (чем больше габариты, тем меньше сопротивление). С уменьшением плотности электролита, т. е. с увеличением степени разряда, ЭДС кислотных аккумуляторов уменьшается, а внутреннее сопротивление увеличивается. Вследствие этого напряжение аккумулятора в начале разрядки понижается незначительно, а к концу падает быстро.
В настоящее время применяются в основном две разновидности щелочных аккумуляторов: кадмиево-никелевые и железо-никелевые.
Электролитом их является раствор едкого калия КОН в дистиллированной воде (плотность электролита 1,19—1,21). В качестве активной массы положительных пластин служит гидрат окиси никеля Ni(OH)3, а активной массы отрицательных – губчатый кадмий Cd (рис. 1.8).
Рис. 1.8. Устройство и принцип действия щелочного кадмиево-никелевого аккумулятора
При разрядке аккумулятора анионы щелочного остатка ОН стремятся к пластинам из чистого кадмия. Избыточные электроны кислотного остатка направляются во внешнюю цепь и к пластинам из гидрата окиси никеля, где они нейтрализуются катионами калия. Таким путем создается разрядный ток аккумулятора.
При разрядке щелочного аккумулятора происходят следующие химические реакции:
у отрицательной пластины
Cd + 20H = Cd(OH)2;
у положительной пластины
Ni (ОН)3 + К = Ni (OH)a + КОН.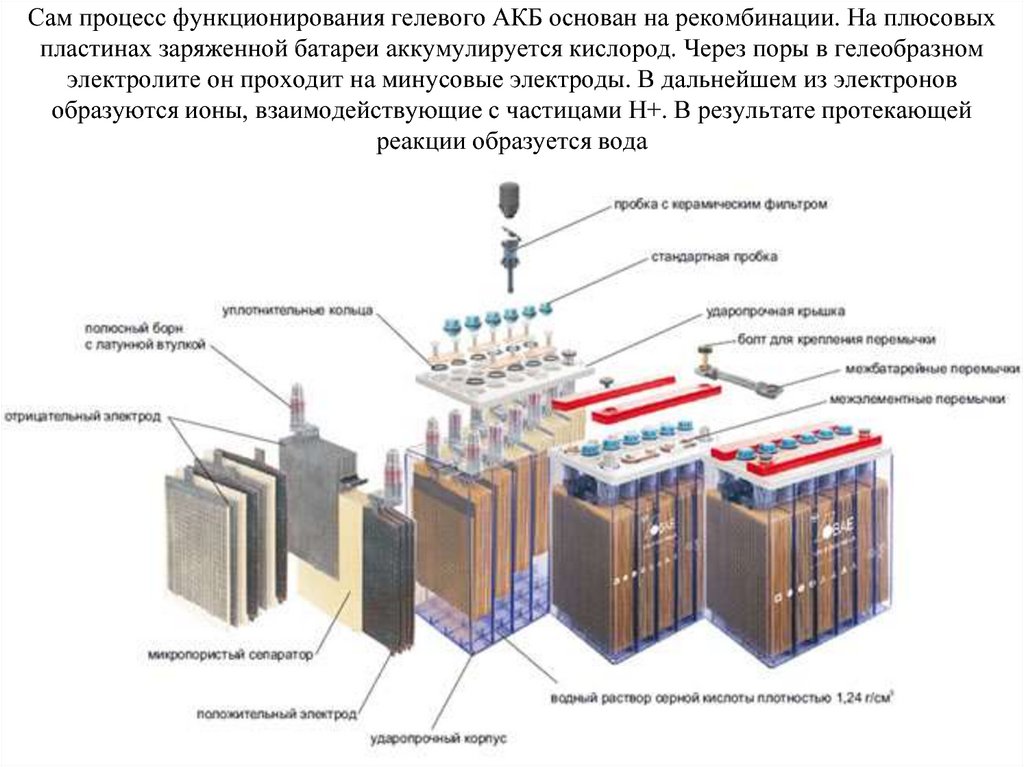
Из данных реакций видно, что при разрядке щелочного аккумулятора кадмий переходит в гидроокись кадмия Cd(OH)2, а трехатомный гидрат окиси никеля Ni(OH)3 – в двухатомную гидроокись никеля Ni(ОН)2. Эти вещества не обладают отрицательными свойствами, поэтому щелочные аккумуляторы не требуют тщательного ухода в эксплуатации, могут быть длительно незаряженными, мало разрушаются при коротких замыканиях.
При зарядке щелочных аккумуляторов катионы калия движутся к отрицательным пластинам, а анионы щелочного остатка – к положительным. При зарядке происходят следующие химические реакции:
у отрицательной пластины
Cd(OH)2 + 2K = 2KOH+Cd;
у положительной пластины
Ni(OH)2 + OH = Ni(OH)3.
При разрядке, и при зарядке щелочных аккумуляторов плотность электролита остается постоянной, так как диссоциация едкого калия на ионы К и ОН компенсируется образованием КОН.
После переработки всех веществ, участвующих в химических реакциях, при зарядке щелочных аккумуляторов происходит разложение воды электролита и «кипение» аккумулятора.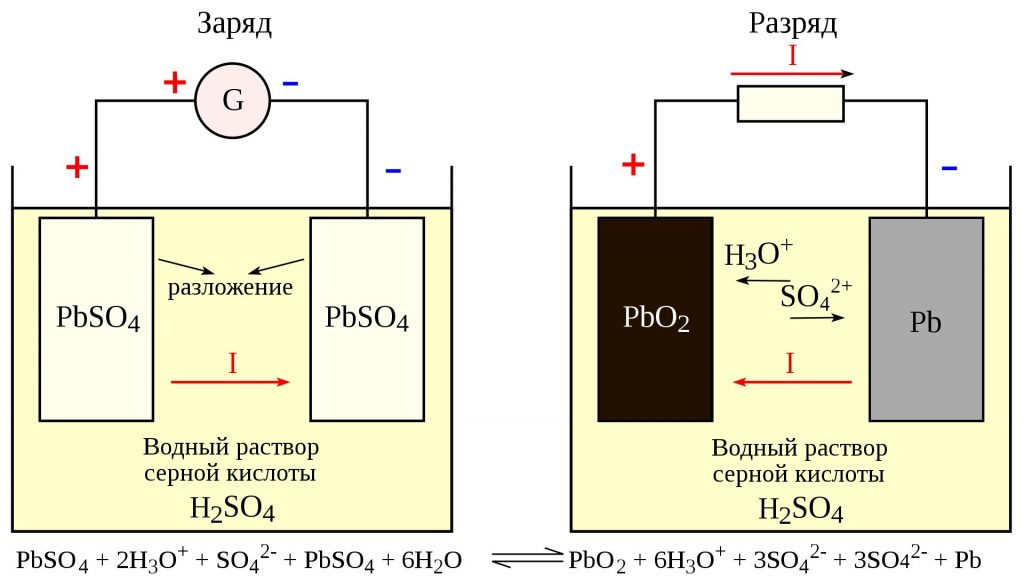
- Назад
- Вперёд
- Назад
- Вперёд
- Вы здесь:
- Главная
- Книги
- Оборудование
- Электрические машины
Еще по теме:
- Предремонтные испытания электрических машин
- Взрывозащищенная контрольно-измерительная и аппаратура автоматики
- Ремонт электрооборудования на судах
- Интеграция системы передачи и хранения ремонтных заявок с системой их режимной проработки
- Строительство, реконструкция и ремонт дымовых труб
Понимание принципа работы и использования сухой батареи
Сухая батарея — это тип химической батареи, в которой используется электролит, находящийся в иммобилизованном состоянии. Электролит в этой аккумуляторной батарее содержит очень мало влаги, чтобы обеспечить прохождение через него тока. В этом посте ScienceStruck рассказывается об истории, определении, составе, использовании и процессе переработки сухих батарей.
Электролит в этой аккумуляторной батарее содержит очень мало влаги, чтобы обеспечить прохождение через него тока. В этом посте ScienceStruck рассказывается об истории, определении, составе, использовании и процессе переработки сухих батарей.
Знаете ли вы?
Сухая батарея была разработана в 1887 году немецким ученым Карлом Гасснером. Позднее это устройство было запатентовано в 19 году.82.
Прежде чем мы начнем с понимания состава и работы сухой батареи, важно понять, что такое батарея. Батарея — это устройство или инструмент, который вырабатывает электричество в результате определенных химических реакций.
В отличие от аккумуляторов с жидкостными элементами, сухие аккумуляторы не подлежат перезарядке. Сухая батарея, как следует из названия, не содержит жидкости. Вместо этого он содержит пасту, которая действует как электролит. Аккумуляторная батарея состоит из пасты, потому что она более густая по консистенции и поэтому не проливается. Этот аккумуляторный электролит содержит мало влаги, ровно столько, чтобы через него протекал ток. Читайте дальше, чтобы узнать больше о сухой батарее.
Читайте дальше, чтобы узнать больше о сухой батарее.
Как работает сухая батарея?
Роль любой батареи заключается в преобразовании химической энергии в электрическую. Сухая аккумуляторная батарея представляет собой батарею, производящую напряжение, содержащую химический электролит в виде густой пасты. Он выдает напряжение около 1,5 вольта. Согласно науке, электрод — это проводник, используемый в батарее для запуска цепи. Он может иметь положительный или отрицательный заряд.
Схема сухой аккумуляторной батареи
На приведенной выше схеме (которая представляет части сухой аккумуляторной батареи) цинковый корпус обеспечивает защиту электролита и катода в целом. Хлорид аммония является электролитом, используемым в батареях этого типа. Сразу перед электролитом лежит диоксид марганца, отделенный от электролита сепаратором или перегородкой. В центре аккумуляторной батареи находится угольный стержень, который является катодом. Цинковая оболочка считается анодом.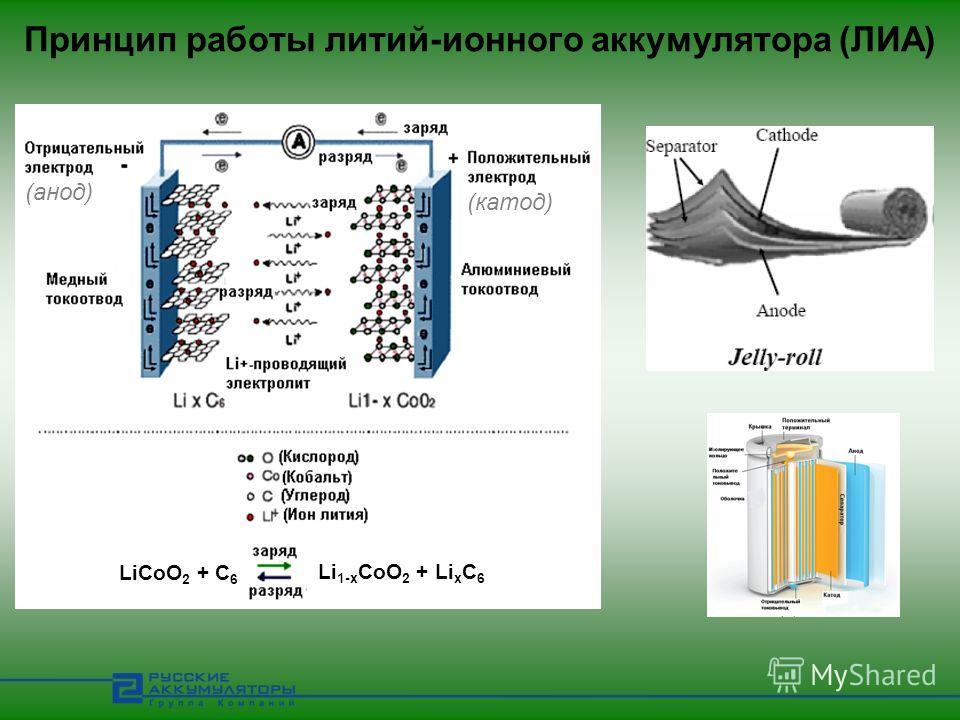
Теперь, когда мы знаем о структуре и частях сухой батареи, давайте разберемся, как она работает. В каждой части аккумуляторного устройства происходят химические реакции. В то время как на угольном электроде происходит реакция восстановления, на цинковом корпусе, который является анодом, происходит окисление. Химические реакции, определяющие весь процесс выработки энергии, следующие:
Ион аммония из хлорида аммония вступает в реакцию с двумя электронами с образованием аммиака и газообразного водорода.
2NH 4 (AQ) + 2E — ➜ 2NH 3 (G) + H 2 (G)
Диоксид -манганский диоксид вблизи катодного реагирования с гид -гиденом с гид -гиденом с гид -гиденов с гид -гиденов с гид -гиденов с гид -гиденом до гид -гидена с гид -гиденом до гид -гид. Оксид марганца(III) и вода.
2MNO 2 (S) + H 2 (G) ➜ MN 2 O 3 (S) + H 2 O (L)
Уравнение I и II I и II WE (L)
. получить,
получить,
2NH 4 (водн.) + 2MnO 2 (т) + 2e- ➜ Mn 2 O 3 (т) + 2NH 3 (г) + H 2 O (л)
0 -Reaction, возникающая в цинковом аноде:
Zn (S) ➜ Zn 2 + + 2E —
Сочетание всех вышеупомянутых уравнений, которые мы получаем,
77 ZN (S) S) (S.). + 2MnO 2 (т) + 2NH 4 (водн.) ➜ Mn 2 O 3 (т) + H 2 O (ж) + Zn 2 + 2NH 3 (г)
Благодаря этим реакциям химическая энергия превращается в электрическую. Затем эта энергия течет от батареи к подключенному устройству через внешнюю цепь.
Примечание:
1) Вместо хлорида аммония можно использовать хлорид цинка.
2) Уголь иногда используется в качестве добавки к диоксиду марганца.
Сухая батарея доступна в различных размерах, таких как AA, AAA, C, D и 9. вольт. Его использование зависит в первую очередь от его размера. В то время как батареи небольшого размера используются в часах или калькуляторах, батареи сравнительно большего размера используются в радиоприемниках и фонариках. Помимо широко используемых угольно-цинковых батарей, другими примерами сухих батарей являются батареи PP3 (также известные как транзисторные батареи для радио), литий-ионные, никель-кадмиевые и никель-металлогидридные батареи.
вольт. Его использование зависит в первую очередь от его размера. В то время как батареи небольшого размера используются в часах или калькуляторах, батареи сравнительно большего размера используются в радиоприемниках и фонариках. Помимо широко используемых угольно-цинковых батарей, другими примерами сухих батарей являются батареи PP3 (также известные как транзисторные батареи для радио), литий-ионные, никель-кадмиевые и никель-металлогидридные батареи.
Проверка сухой батареи
Вещи, которые вам понадобятся:
• Мультиметр
• Батарейка AA
1) Мультиметр должен быть настроен на считывание напряжения.
2) Красный наконечник щупа должен касаться верхней части батареи, а кончик черного щупа должен касаться нижней части батареи.
3) Мультиметр должен показывать напряжение 1,5 вольта. Если это так, это означает, что аккумулятор находится в хорошем состоянии. Даже незначительное отклонение указывает на необходимость замены батареи.
Использование
➢ Батарейки большего размера используются в фонариках, пультах дистанционного управления, радиоприемниках и т. д. Батарейки меньшего размера используются в наручных часах, видеоиграх, калькуляторах, портативных электронных устройствах и т. д.
д. Батарейки меньшего размера используются в наручных часах, видеоиграх, калькуляторах, портативных электронных устройствах и т. д.
➢ Они используются в малых двигателях (в основном, жестких дисках, инвалидных креслах и т. д.) и больших двигателях (в основном судовых, автомобильных и т. д.).
Преимущества сухих батарей
➢ Они имеют более низкую цену по сравнению с жидкостными батареями.
➢ Электролит в виде густой пасты не подвижен. Таким образом, эти батареи служат дольше.
➢ Важнейшим преимуществом является небольшой размер и компактная форма. Это делает их портативными и подходящими для небольших устройств.
➢ Не содержат жидких электролитов. Это делает их более легкими, чем их аналоги с мокрыми ячейками.
➢ Не представляют опасности для окружающей среды, так как не содержат веществ, обладающих коррозионной природой.
Процесс переработки
Сухие батареи бывают первичного и вторичного типов. В то время как первичные нельзя пополнить зарядкой, вторичные можно зарядить.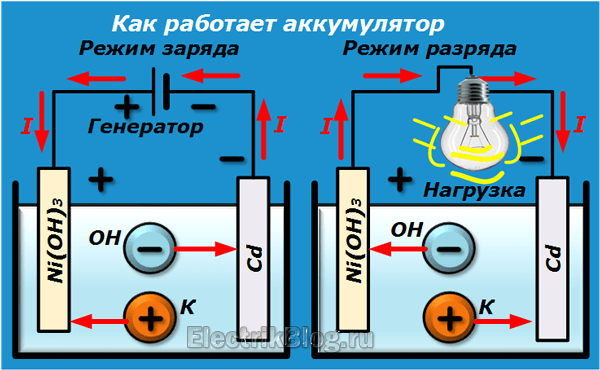 Таким образом, первичные должны быть утилизированы, когда они перестают работать. Хотя известно, что они не представляют опасности для природы, их утилизация должна осуществляться надлежащим образом. Щелочные батареи можно утилизировать вместе с обычным мусором. Другим весьма уместным решением этой проблемы может стать использование вторичных сухих аккумуляторных батарей. Это позволит перезаряжать и повторно использовать аккумуляторы, тем самым уменьшая количество мусора.
Таким образом, первичные должны быть утилизированы, когда они перестают работать. Хотя известно, что они не представляют опасности для природы, их утилизация должна осуществляться надлежащим образом. Щелочные батареи можно утилизировать вместе с обычным мусором. Другим весьма уместным решением этой проблемы может стать использование вторичных сухих аккумуляторных батарей. Это позволит перезаряжать и повторно использовать аккумуляторы, тем самым уменьшая количество мусора.
Хотя сухие батареи имеют относительно низкую способность производить заряд, они находят ряд применений в небольших устройствах, требующих меньшей мощности. И, как гласит пословица В единстве заключается сила , несколько соединенных вместе сухих батарей обеспечивают большее напряжение.
Литий-ионная батарея Принцип работы и применение — StudiousGuy
Литий-ионная батарея — это тип перезаряжаемой батареи, в которой используются заряженные частицы лития для преобразования химической энергии в электрическую. М. Стэнли Уиттингем, британо-американский химик, известен как отец-основатель литий-ионных аккумуляторов. Он разработал концепцию перезаряжаемых батарей в конце 19 века.70-е годы. В 2019 году М. Стэнли Уиттингем, Джон Гуденаф и Акира Йошино были удостоены Нобелевской премии по химии за свою работу. По способности к перезарядке литий-ионные аккумуляторы можно разделить на две большие категории, а именно первичные и вторичные. Первичные литий-ионные аккумуляторы не подлежат перезарядке, а вторичные литий-ионные аккумуляторы можно перезаряжать.
М. Стэнли Уиттингем, британо-американский химик, известен как отец-основатель литий-ионных аккумуляторов. Он разработал концепцию перезаряжаемых батарей в конце 19 века.70-е годы. В 2019 году М. Стэнли Уиттингем, Джон Гуденаф и Акира Йошино были удостоены Нобелевской премии по химии за свою работу. По способности к перезарядке литий-ионные аккумуляторы можно разделить на две большие категории, а именно первичные и вторичные. Первичные литий-ионные аккумуляторы не подлежат перезарядке, а вторичные литий-ионные аккумуляторы можно перезаряжать.
Указатель статей (Щелкните, чтобы перейти)
Принцип работы литий-ионной батареи
Литий-ионные батареи работают по принципу кресла-качалки. Здесь преобразование химической энергии в электрическую происходит с помощью окислительно-восстановительных реакций. Обычно литий-ионный аккумулятор состоит из двух или более электрически соединенных гальванических элементов. Когда батарея заряжена, ионы стремятся двигаться к отрицательному электроду или аноду. Когда аккумулятор полностью разряжается, ионы лития возвращаются обратно к положительному электроду, то есть к катоду. Это означает, что во время процесса зарядки и разрядки ионы лития перемещаются между двумя электродами батареи, поэтому принцип работы литий-ионной батареи называется принципом кресла-качалки.
Когда аккумулятор полностью разряжается, ионы лития возвращаются обратно к положительному электроду, то есть к катоду. Это означает, что во время процесса зарядки и разрядки ионы лития перемещаются между двумя электродами батареи, поэтому принцип работы литий-ионной батареи называется принципом кресла-качалки.
Работа литий-ионной батареи
Батарея обычно состоит из двух электродов, а именно анода и катода. Катод образует положительную клемму батареи, а анод предназначен для отрицательной клеммы. Катод литий-ионной батареи в основном состоит из соединения лития, а основным элементом анода является графит. Когда батарея подключена к источнику питания, ионы лития имеют тенденцию перемещаться от катода к аноду, то есть от положительного электрода к отрицательному электроду. Это называется зарядкой аккумулятора. Во время фазы разрядки батареи движение ионов лития меняется на противоположное от анода к катоду, то есть от отрицательного электрода к положительному, и электрическая энергия передается на подключенную нагрузку.
Использование литий-ионных аккумуляторов
Сотовые устройства
Почти все сотовые устройства, такие как мобильные телефоны, ноутбуки, беспроводные телефоны и т. д., используют литий-ионные аккумуляторы. Это связано с тем, что литий-ионные аккумуляторы компактны, легки и пригодны для повторного использования. Следовательно, они идеально подходят для портативных устройств. Кроме того, такие типы батарей обеспечивают быструю скорость зарядки, что позволяет пользователю часто получать доступ к устройствам без помех.
Power Banks
Power Bank — это портативный гаджет, который помогает пользователю удобно заряжать электронные устройства, такие как мобильные телефоны, смарт-часы и т. д., в любом месте и в любое время. Для этой цели в Power Bank обычно используются литий-ионные и литий-полимерные аккумуляторы.
Электромобили
Ряд электромобилей, таких как электромобили, электрические велосипеды, электрические скутеры, электрические велосипеды и т. д., используют для своей работы литий-ионные батареи. Это связано с тем, что литий-ионные аккумуляторы имеют высокое отношение мощности к весу, большую устойчивость к колебаниям температуры и давления и более высокую плотность энергии, чем свинцово-кислотные аккумуляторы. Кроме того, они легкие, портативные, эффективные и более безопасные, чем традиционные батареи.
д., используют для своей работы литий-ионные батареи. Это связано с тем, что литий-ионные аккумуляторы имеют высокое отношение мощности к весу, большую устойчивость к колебаниям температуры и давления и более высокую плотность энергии, чем свинцово-кислотные аккумуляторы. Кроме того, они легкие, портативные, эффективные и более безопасные, чем традиционные батареи.
Медицинские устройства
Медицинские устройства, такие как слуховые аппараты, хирургические инструменты, диагностические аппараты, кардиостимуляторы, дефибрилляторы, роботы-помощники, инфузионные насосы, мониторы частоты сердечных сокращений и пульса и т. д., используют литий-ионные батареи для различных диагностических и цели лечения. К преимуществам использования литий-ионных аккумуляторов в медицинских гаджетах можно отнести высокое быстродействие, быструю скорость зарядки, малый вес, безопасность и др.
Камеры
Литий-ионные аккумуляторы широко используются в цифровых зеркальных фотокамерах, поскольку они способны обеспечивать высокую мощность в течение сравнительно более длительного времени, чем традиционные аккумуляторы. Кроме того, литий-ионные аккумуляторы предпочтительнее, потому что они легкие, а значит, не делают гаджет громоздким. В некоторых камерах также используются перезаряжаемые литий-ионные батареи, что позволяет пользователю повторно использовать их и повышает надежность.
Кроме того, литий-ионные аккумуляторы предпочтительнее, потому что они легкие, а значит, не делают гаджет громоздким. В некоторых камерах также используются перезаряжаемые литий-ионные батареи, что позволяет пользователю повторно использовать их и повышает надежность.
ИБП
ИБП (система бесперебойного питания) — это устройство, которое обеспечивает резервное питание в течение определенного периода времени в случае отключения или сбоя питания. В таких устройствах обычно используется комбинация литий-ионных аккумуляторов. Это связано с тем, что использование литий-ионных аккумуляторов в устройствах ИБП уменьшает занимаемую площадь на 50-80%. Кроме того, система ИБП на основе литий-ионных аккумуляторов весит на 60–80 % меньше, чем обычное устройство ИБП на основе свинцово-кислотных батарей.
Роботы
Литий-ионные аккумуляторы очень популярны в области робототехники и автоматизации. Они используются для питания роботов-гуманоидов, а также промышленных роботов.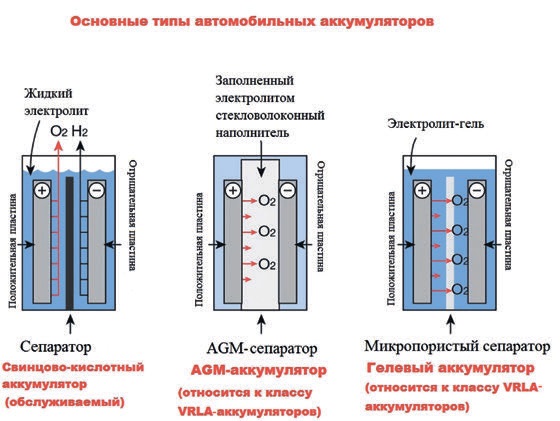
Преимущества литий-ионных аккумуляторов
1. Литий-ионные аккумуляторы имеют значительно более низкую скорость саморазряда по сравнению с другими типами аккумуляторов.
2. Обладают высокой плотностью энергии.
3. В литий-ионных батареях отсутствует эффект памяти.
4. Средний срок службы литий-ионных аккумуляторов в десять раз больше, чем у традиционных свинцово-кислотных аккумуляторов.
5. Высокая скорость зарядки литий-ионных аккумуляторов.
6. Литий-ионные аккумуляторы эффективно работают в экстремальных условиях, таких как высокое давление и колебания температуры.
7. Литий-ионные аккумуляторы легкие и компактные. Как правило, вес литий-ионных аккумуляторов примерно на 50-60% меньше, чем у стандартных свинцово-кислотных аккумуляторов.
8. Установка литий-ионных аккумуляторов сравнительно проста.
9. Аккумуляторы этого типа гибкие, менее громоздкие и безопасные в использовании.
10. Литий-ионные аккумуляторы доступны в различных формах и размерах.