Содержание
Как работает литиевая батарея — подробное устройство
Обновленная статья от: 10.11.2020
Литий-ионные аккумуляторы – универсальный тип элементов питания. Они используются в смартфонах, фонариках, портативной технике, специнструменте, источниках
бесперебойного питания. Литий-ионные батареи обеспечивают автономное питание складской и клининговой техники, электромобилей, гольфкаров, инвалидных колясок, гироскутеров, самокатов, велосипедов на электротяге и многих других устройств.
Источники питания на основе лития отличаются высокой энергоемкостью при относительно малых размерах и массе. Дополнительными их преимуществами выступают:
- большой ресурс – более 1000 полных циклов заряд-разряд;
- малый саморазряд – не более 5–10 % в год;
- высокая токоотдача;
- широкий диапазон допустимых температур – от -20 до +60 °С при работе, от 0 до +45 °С при подзарядке;
- простота и удобство использования.
Литиевый аккумулятор – устройство и принцип работы
В структуре Li-ion аккумулятора есть катод из производных лития на алюминиевой фольге и графитовый анод на фольге из меди. В качестве производных лития используются различные соединения: LiCoO2, LiMn2O4, LiFePO4, LiNiO2, LiMnRON, LiC6, LiMnO2, Li4Ti5O12 и др. Между катодом и анодом находится пористый сепаратор, пропитанный электролитом с функциями проводника. Заряд переносят ионы лития, легко встраиваемые в кристаллическую решетку пористого углерода и вызывающие соответствующую химическую реакцию.
В качестве производных лития используются различные соединения: LiCoO2, LiMn2O4, LiFePO4, LiNiO2, LiMnRON, LiC6, LiMnO2, Li4Ti5O12 и др. Между катодом и анодом находится пористый сепаратор, пропитанный электролитом с функциями проводника. Заряд переносят ионы лития, легко встраиваемые в кристаллическую решетку пористого углерода и вызывающие соответствующую химическую реакцию.
Конструкция из электродов и находящегося между ними сепаратора сворачивается в виде рулона и помещается в герметичную оболочку из стали, алюминия или полимерного материала. При этом электроды подсоединяются к токосъемникам. В итоге получаются Li-ion элементы цилиндрической или призматической формы – в зависимости от принципа сворачивания фольги. Самый распространенный типоразмер Li-ion аккумуляторов в форме цилиндра – 18650.
Как работает Li-ion аккумулятор
Принцип действия литий-ионного аккумулятора заключается в создании необходимых условий для перемещения ионов лития между катодом и анодом:
- При подаче на электроды напряжения ионы лития отрываются от катода, переходят через сепаратор к графитовому аноду и встраиваются в его молекулярную структуру.
 В результате протекает реакция окисления, и аккумулятор заряжается.
В результате протекает реакция окисления, и аккумулятор заряжается. - При подаче нагрузки ионы лития перемещаются обратно к катоду. Углеродистая пластинка на медной фольге становится «минусом», а производные лития на алюминии – «плюсом».
Задачи и функции BMS платы
Слабым местом Li-ion аккумуляторов считается их чувствительность к перезарядам и глубоким разрядам. Чтобы напряжение элементов автоматически поддерживалось в безопасном диапазоне, батарея оснащается BMS платой контроля и защиты. Она автоматически размыкает выходные ключи – отключает АКБ от нагрузки при критическом разряде и от сети при полном заряде. БМС плата оберегает элементы питания и от короткого замыкания. В таких ситуациях напряжение на элементах питания резко просаживается, и мгновенно срабатывает защита от глубокого разряда. Тем самым модуль защиты продлевает срок службы АКБ.
Основой BMS платы выступает микросхема. В ней есть полевые транзисторы, используемые для раздельного управления защитой на протяжении заряда и разряда ячеек. Плата защиты следит, чтобы напряжение на каждой ячейке не превышало 4,2 В и не опускалось ниже 2,3 В. Также в схеме обычно присутствует датчик, замеряющий уменьшение напряжения на полевых транзисторах. Функции измерительного шунта выполняет переходное сопротивление транзисторов. В ряде плат дополнительно используется детектор токовых перегрузок.
Плата защиты следит, чтобы напряжение на каждой ячейке не превышало 4,2 В и не опускалось ниже 2,3 В. Также в схеме обычно присутствует датчик, замеряющий уменьшение напряжения на полевых транзисторах. Функции измерительного шунта выполняет переходное сопротивление транзисторов. В ряде плат дополнительно используется детектор токовых перегрузок.
Как работает контроллер заряда в литиевой батарее
Контроллер заряда – важная составляющая зарядного устройства, которая обеспечивает правильный режим подзарядки. Для литиевых элементов это режим CC/CV – вначале осуществляется зарядка при неизменном токе, а затем – при стабильном напряжении.
Контроллер ограничивает зарядный ток и контролирует объем энергии, поступающей на ячейки в единицу времени. Избыточную энергию он рассеивает в виде тепла. При достижении порога срабатывания 4,2 В контроллер переключается в режим стабилизации напряжения и плавно уменьшает ток заряда.
Режимы работы литиевых АКБ
Есть 2 основных режима использования литиевых АКБ:
- Буферный – например, в современных источниках бесперебойного питания.
 Батарея в таком случае постоянно подпитывается от электросети, а при перебоях в электроснабжении – отдает накопленный заряд подключенному к ней оборудованию. Когда электроснабжение от сети восстанавливается, АКБ снова подзаряжается и находится в режиме постоянной готовности к дальнейшему использованию.
Батарея в таком случае постоянно подпитывается от электросети, а при перебоях в электроснабжении – отдает накопленный заряд подключенному к ней оборудованию. Когда электроснабжение от сети восстанавливается, АКБ снова подзаряжается и находится в режиме постоянной готовности к дальнейшему использованию. - Циклический – подразумевает чередование фаз заряд-разряд, когда после пассивной фазы восстановления заряда следует продолжительная фаза активной работы. В таком режиме работают аккумуляторные батареи электровелосипедов и других видов персонального электротранспорта, погрузчиков, поломоечных машин, электромобилей, мотолодок, мобильных кофемашин и другой техники. Срок службы таких АКБ измеряется не годами, а количеством циклов глубокого разряда (до 80%) и последующего заряда.
Литий-ионные батареи успешно используются и в буферном, и в циклическом режиме. Если эксплуатация АКБ подразумевает жесткие условия и частые глубокие разряды, лучше всего с такими задачами справляются литий-железо-фосфатные батареи (LiFePO4).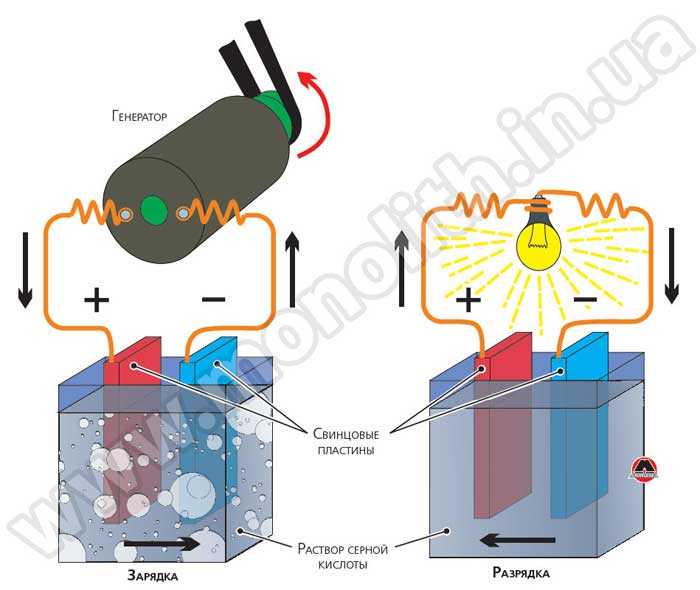 В частности, они используются для питания лодочных электромоторов, складской и клининговой техники, е-байков и других видов электротранспорта.
В частности, они используются для питания лодочных электромоторов, складской и клининговой техники, е-байков и других видов электротранспорта.
Старение и деградация литиевых АКБ
В результате циклического заряда-разряда литиевые аккумуляторы постепенно «стареют» – ионы лития не всегда возвращаются в свое исходное положение, состояние катода меняется, в системе накапливаются продукты окисления. В итоге аккумуляторная батарея медленно и безвозвратно утрачивает часть своей емкости.
Считается, что при потере 30% исходной емкости жизненный цикл батареи завершается. При потере емкости на 50% батарея подлежит утилизации. Рабочий ресурс батареи определяется как количество полных циклов заряда-разряда до тех пор, когда емкость АКБ снизится на 20%. В среднем ресурс Li-ion аккумуляторов составляет 1000 циклов, у моделей вида LiFePO4 – более 2000, а у литий-титанатных – более 20 000.
Рекомендации по использованию
Чтобы продлить срок службы Li-ion батарей, нужно:
- Следовать рекомендациям производителя по их эксплуатации.

- Не превышать рекомендованный зарядный ток. Оптимальным током заряда считается значение, равное 50% номинальной емкости батареи. Так, для АКБ емкостью 10 Ач оптимальный зарядный ток составляет 5 А. Исключение – современные литий-титанатные модели. Они допускают токовые нагрузки до 10С.
- Избегать перезаряда, глубокого разряда батарей, их длительного хранения в разряженном состоянии, механических повреждений, перегрева и переохлаждения.
Используйте литиевые АКБ правильно, и они долго будут радовать вас отличными рабочими характеристиками.
Предлагаем для ознакомления обзор электрических фэтбайков – электровелосипедов с толстыми колесами.
Как работает чехол аккумулятор (инструкция)
К сравнению
В избранное
- Обзор
- Доставка по Москве: 250₽.
 К метро: 149₽. По России: от 200₽
К метро: 149₽. По России: от 200₽ - Оплата картой или наличными
- Легкий возврат и обмен курьером бесплатно
Обзор
Как это работает?
Чехол зарядка имеет встроенный литий-полимерный аккумулятор внутри. Поместите телефон в чехол, чтобы коннектор соединился с разъемом в нижней части телефона. Далее включите переключатель (на задней или передней части чехла), чтобы начать зарядку Вашего телефона. На многих моделях чехлов имеются светодиодные индикаторы (от 1 до 4 лампочек) — они показывают уровень заряда… 25,50,75,100%
После того, как чехол разрядится, просто зарядите его полностью с помощью входящего в комплект микро USB кабеля. В некоторых моделях (с таким же разъемом как у телефона) — кабель в комплекте не поставляется, такой чехол заряжается зарядкой от телефона. Заряжать можно чехол от сети 220 Вольт или от компьютера через USB порт.
Заряжать можно чехол от сети 220 Вольт или от компьютера через USB порт.
Почему светодиоды мигают в то время как чехол заряжается:
После подключения к источнику питания, индикатор состояния начинает мигать, указывая уровень своего заряда. Не забудьте проверить индикатор состояния, прежде чем отключить от сети или компьютера. Когда все светодиоды горят, значит Ваш чехол-зарядка полностью заряжен.
Рекомендации по использованию чехла:
Если предположить, что телефон и чехол полностью заряжены, мы рекомендуем подождать, пока телефон не разрядится более чем на 80%.
Срок службы чехлов с аккумуляторами ?
Чехол перезаряжается более 500 полных циклов. Полный цикл — это зарядка от 0% до 100%. Частичные циклы не считаются полными циклами. После 500 циклов, батарея может обеспечить менее 75% от первоначальной емкости. Это норма для любого продукта с литиево-полимерный аккумулятором.
Возможно ли синхронизировать телефон не вынимая из чехла ?
Да. Вы можете синхронизировать свой гаджет по сети WiFi или с помощью USB кабеля
Вы можете синхронизировать свой гаджет по сети WiFi или с помощью USB кабеля
Разъемы под динамик, микрофон, камеру или любые другие порты
Чехлы сконструированы таким образом, чтобы у Вас был доступ ко всем кнопкам и разъемам телефона. В большинстве моделях, где динамик закрыт чехлом — звук перенаправлен из нижней части телефона на переднюю.
Чехол ни при каких обстоятельствах не влияет на прием сигнала антенной телефона
Каталог чехлов с аккумуляторами
Доставка по Москве: 250₽. К метро: 149₽. По России: от 200₽
По Москве на адрес 250₽ (пределы МКАД) | К метро: 149₽ | За МКАД: 250+50р/км.
| Доставка по России: 200₽ в офис СДЭК
| Почтой России: 300₽
Оплата картой или наличными
Способы оплаты :
Наличными курьеру при получении. |
|
Банковскими картами MasterCard, Visa, МИР: онлайн на сайте |
Яндекс Деньги: онлайн на сайте |
Безналичный расчет (для юридических лиц)
Легкий возврат и обмен курьером бесплатно
По Москве курьером. По России: Почтой или СДЭК
Инженерная школа Массачусетского технологического института | » Как работает батарея?
Как работает батарея?
Ваши часы, ноутбук и лазерная указка питаются от одного и того же: химии…
Автор: Мэри Бейтс . «Аккумулятор — это устройство, способное накапливать электрическую энергию в виде химической энергии и преобразовывать эту энергию в электричество», — говорит Антуан Алланоре, научный сотрудник факультета материаловедения и инженерии Массачусетского технологического института. «Вы не можете поймать и сохранить электричество, но вы можете хранить электрическую энергию в химических веществах внутри батареи».
Батарея состоит из трех основных компонентов: две клеммы, изготовленные из разных химических веществ (обычно металлов), анод и катод; и электролит, который разделяет эти клеммы. Электролит представляет собой химическую среду, которая обеспечивает протекание электрического заряда между катодом и анодом. Когда устройство подключено к батарее — лампочке или электрической цепи — на электродах происходят химические реакции, которые создают поток электрической энергии к устройству.
Более конкретно: во время разряда электричества химическое вещество на аноде высвобождает электроны на отрицательную клемму и ионы в электролит посредством так называемой реакции окисления. Между тем, на положительной клемме катод принимает электроны, замыкая цепь потока электронов. Электролит предназначен для того, чтобы привести различные химические вещества анода и катода в контакт друг с другом таким образом, чтобы химический потенциал мог уравновешиваться от одного вывода к другому, преобразовывая накопленную химическую энергию в полезную электрическую энергию.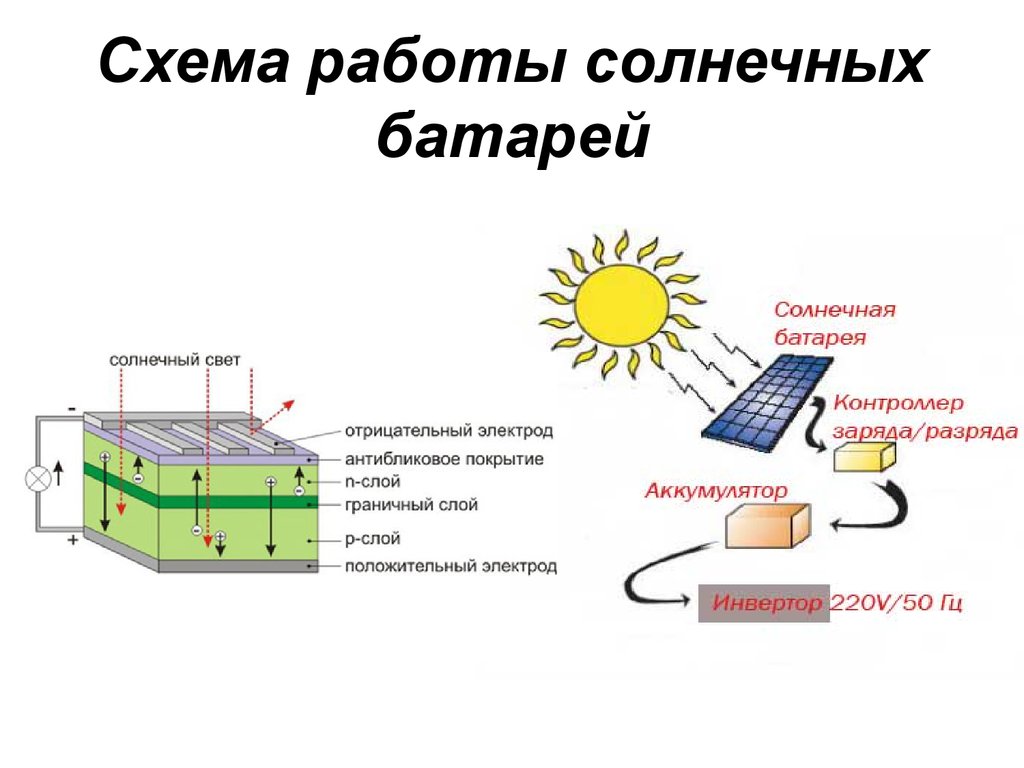 «Эти две реакции происходят одновременно», — говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и именно это генерирует электрический ток».
«Эти две реакции происходят одновременно», — говорит Алланор. «Ионы переносят ток через электролит, в то время как электроны текут во внешней цепи, и именно это генерирует электрический ток».
Если батарея одноразовая, она будет производить электричество до тех пор, пока не закончатся реагенты (одинаковый химический потенциал на обоих электродах). Эти батареи работают только в одном направлении, преобразуя химическую энергию в электрическую. Но в других типах аккумуляторов реакция может быть обратной. Перезаряжаемые батареи (например, в вашем мобильном телефоне или в вашем автомобиле) сконструированы таким образом, что электрическая энергия из внешнего источника (зарядное устройство, которое вы подключаете к стене, или динамо-машина в вашем автомобиле) может быть применена к химической системе и наоборот. его работы, восстанавливая заряд аккумулятора.
Лаборатория Group Sadoway в Массачусетском технологическом институте работает над созданием более эффективных аккумуляторов для многократного использования. Для крупномасштабного хранения энергии команда работает над жидкометаллической батареей, в которой электролит, анод и катод являются жидкими. Для портативных приложений разрабатывается тонкопленочная полимерная батарея с гибким электролитом из негорючего геля. Еще одной целью лаборатории является создание аккумуляторов с использованием ранее не рассматривавшихся материалов, с упором на широко распространенные, дешевые и безопасные вещества, которые имеют такой же коммерческий потенциал, как и популярные литиевые аккумуляторы.
Для крупномасштабного хранения энергии команда работает над жидкометаллической батареей, в которой электролит, анод и катод являются жидкими. Для портативных приложений разрабатывается тонкопленочная полимерная батарея с гибким электролитом из негорючего геля. Еще одной целью лаборатории является создание аккумуляторов с использованием ранее не рассматривавшихся материалов, с упором на широко распространенные, дешевые и безопасные вещества, которые имеют такой же коммерческий потенциал, как и популярные литиевые аккумуляторы.
Спасибо 18-летнему Стивену Минкусу из Гленвью, Иллинойс, за этот вопрос.
Опубликовано: 1 мая 2012 г.
Как работает батарея?
Энергия не может быть создана или уничтожена, но ее можно сохранить в различных формах. Один из способов его хранения — в виде химической энергии в батарее. При подключении к цепи батарея может производить электричество.
Батареи преобразуют химическую энергию в электрическую |
Батарея имеет два вывода: положительный (катод) и отрицательный (анод).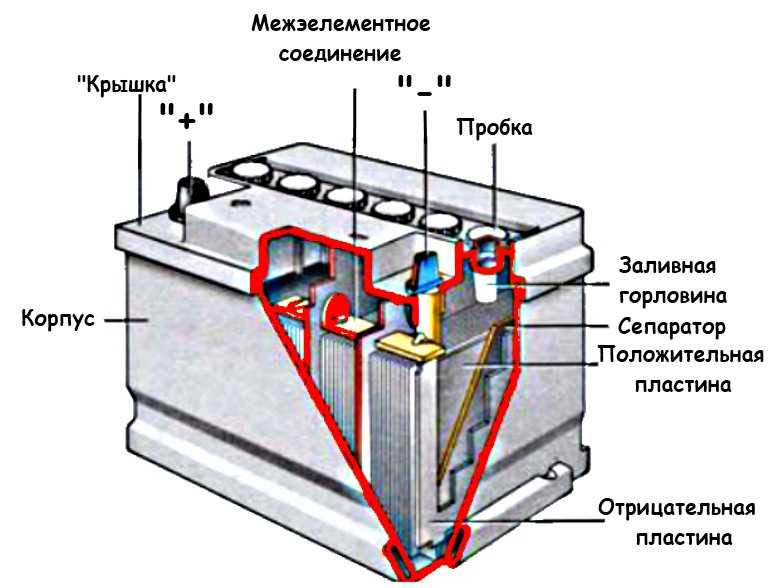 Если вы соедините две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
Если вы соедините две клеммы проводом, образуется цепь. Электроны будут течь по проводу, и будет производиться электрический ток. Внутри батареи происходит реакция между химическими веществами. Но реакция происходит только при наличии потока электронов. Батареи могут храниться в течение длительного времени и продолжать работать, потому что химический процесс не начнется, пока электроны не перейдут от отрицательного к положительному выводу через цепь.
В батарее происходит химическая реакция
Простой пример – батарея из лимонных элементов
Давайте начнем с очень простой батареи, в которой используется лимон, в который, например, вставлены два разных металлических предмета. оцинкованный гвоздь и медная монета или проволока. Медь служит положительным электродом или катодом, а гальванизированный (оцинкованный) гвоздь — отрицательным электродом или анодом, производящим электроны. Эти два объекта работают как электроды, вызывая электрохимическую реакцию, которая создает небольшую разность потенциалов.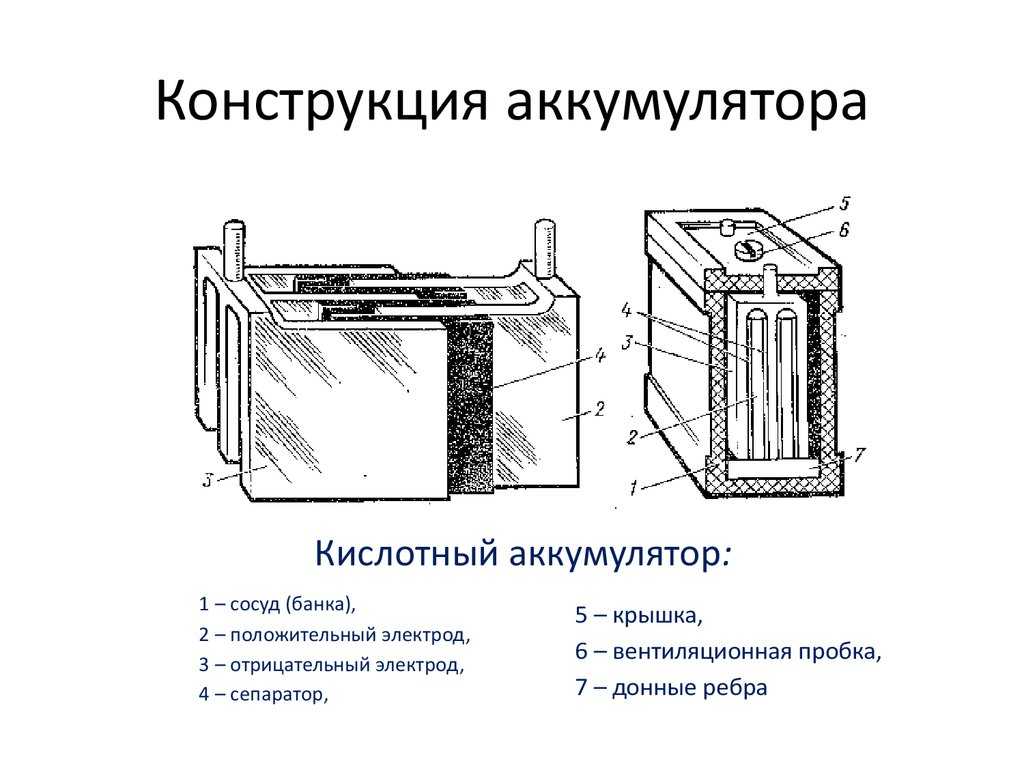
Поскольку атомы меди (Cu) притягивают электроны больше, чем атомы цинка (Zn), если вы поместите кусок меди и кусок цинка в контакт друг с другом, электроны перейдут от цинка к меди. Когда электроны концентрируются на меди, они будут отталкиваться друг от друга и останавливать поток электронов от цинка к меди. С другой стороны, если вы поместите полоски цинка и меди в проводящий раствор и соедините их снаружи проводом, реакции между электродами и раствором позволят электронам непрерывно течь по проводу.
ЛИМОННАЯ БАТАРЕЯ | Как работает лимонная батарейка? Лимонная батарея состоит из лимона и двух металлических электродов из разных металлов, таких как медная монета или проволока, и оцинкованного (оцинкованного) гвоздя. Энергия для батареи исходит не от лимона, а от химического превращения цинка (или другого металла). Если предположить, что используются цинковые и медные электроды (например, медная монета и оцинкованный гвоздь), то один лимон может генерировать примерно 0,9 Вольт. Слева последовательная цепь лимонов показывает, что вырабатывается 3,41 вольта. ПРИМЕЧАНИЕ: Можно использовать картофель, яблоки, квашеную капусту или любые другие фрукты или овощи, содержащие кислоту или другой электролит, но лимоны предпочтительнее из-за их более высокой кислотности. Например, в картофеле электролитом является фосфорная кислота, а в лимонах — лимонная кислота. |
В лимонной батарее происходит как окисление (потеря электронов), так и восстановление (приобретение электронов). Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Эта батарея похожа на оригинальные «простые гальванические элементы», изобретенные Алессандро Вольта (см. Ниже). На аноде металлический цинк окисляется и переходит в кислый раствор в виде ионов Zn2+:
Zn —> Zn2+ + 2 e-
На медном катоде ионы водорода (сольватированные протоны из кислого раствора в лимоне) восстанавливаются с образованием молекулярного водорода:
2H++ 2e- —> h3
Что заставляет электроны двигаться?
Когда вы отпускаете мяч, который держите в руках, он падает на землю, потому что гравитационное поле Земли тянет мяч вниз. Точно так же заряженные частицы, такие как электроны, должны совершить работу, чтобы переместиться из одной точки в другую. Количество работы на единицу заряда называется разностью электрических потенциалов между двумя точками. Единица разности потенциалов называется вольт.
Разность потенциалов между катодом и анодом определяется химической реакцией. Внутри батареи электроны подталкиваются химической реакцией к положительному концу, создавая разность потенциалов.
Именно эта разность потенциалов заставляет электроны двигаться по проводу.
Разность потенциалов может быть положительной или отрицательной, подобно гравитационной энергии, движущейся вверх или вниз по склону. В батарее поток электронов направлен вниз… электроны могут течь вверх, как в случае с зарядным устройством.
Почему внутри батареи электроны не перемещаются от анода к катоду?
Электролит в батарее не дает одиноким электронам двигаться прямо от анода к катоду внутри батареи. Когда клеммы соединены токопроводящим проводом, электроны могут легко течь от анода к катоду.
В каком направлении движутся электроны в проводе?
Электроны заряжены отрицательно, поэтому они будут притягиваться к положительному концу батареи и отталкиваться от отрицательного конца. Когда батарея подключена к устройству, которое позволяет электронам течь через нее, они текут от отрицательного (анодного) к положительному (катодному) выводу.
Кто изобрел гальванический элемент (батарейку)?
ПЕРВАЯ БАТАРЕЯ VOLTA | Аккумулятор производства Volta считается первым гальваническим элементом. Теперь у нас есть две клеммы, и если мы их соединим, потечет ток. Реакции в этой ячейке следующие: цинк Zn —> Zn2+ + 2e- серная кислота 2H+ + 2e- —> h3 Медь не вступает в реакцию, действуя как электрод для химической реакции. |
Как работает современный аккумулятор (угольно-цинковый аккумулятор)?
Сухой угольно-цинковый элемент или батарея упакованы в цинковую банку, которая служит как контейнером, так и отрицательной клеммой (анодом). Цинк окисляется в соответствии со следующим полууравнением. Диоксид марганца смешивают с угольным порошком для увеличения электропроводности. Реакция выглядит следующим образом: 2MnO2(т) + 2 e- + 2Nh5Cl(водн.) —> , а CL сочетается с Zn2+. В этой полуреакции марганец восстанавливается из степени окисления (+4) в (+3). Zn(т) + 2MnO2(т) + 2Nh5Cl(водн.) —> Mn2O3(т) + Zn(Nh4)2Cl2 (водн.) + h3O(ж) Аккумулятор имеет Э.Д.С. около 1,5 В. |
Какие существуют типы батарей?
В разных типах батарей используются разные химические вещества и химические реакции. Некоторые из наиболее распространенных типов батарей:
Щелочные батареи | Используется в батареях Duracell® и Energizer® и других щелочных батареях. Электроды цинково-марганцево-оксидные. Электролит представляет собой щелочную пасту. |
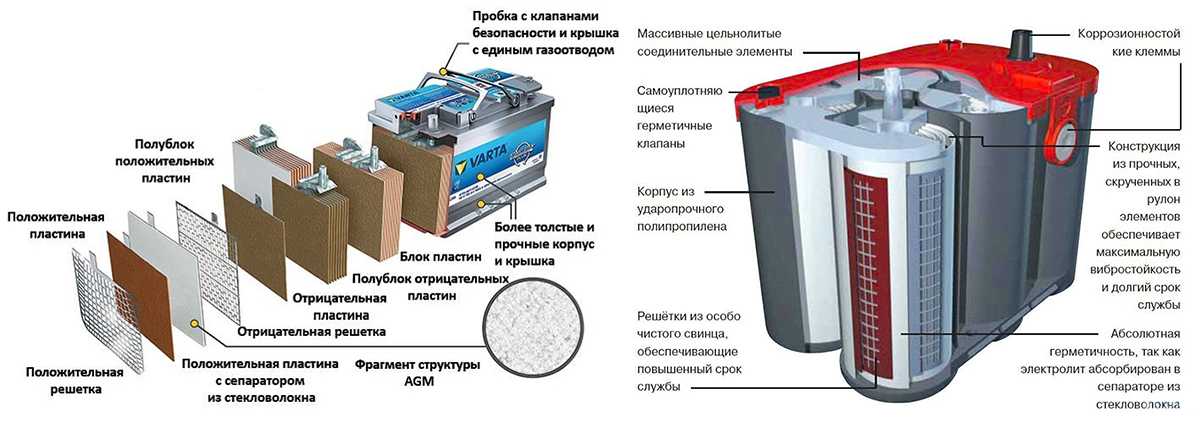
Свинцово-кислотный аккумулятор | Используются в автомобилях. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. Электроды изготовлены из свинца и оксида свинца с сильной кислотой в качестве электролита. |
Литиевая батарея | Эти батарейки используются в камерах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литиевая батарея | Эти батарейки используются в камерах для вспышки. Они изготавливаются из лития, йодида лития и йодида свинца. Они могут обеспечить скачки электричества для вспышки. |
| Литий-ионный аккумулятор | Эти батареи используются в портативных компьютерах, сотовых телефонах и другом портативном оборудовании с интенсивным использованием.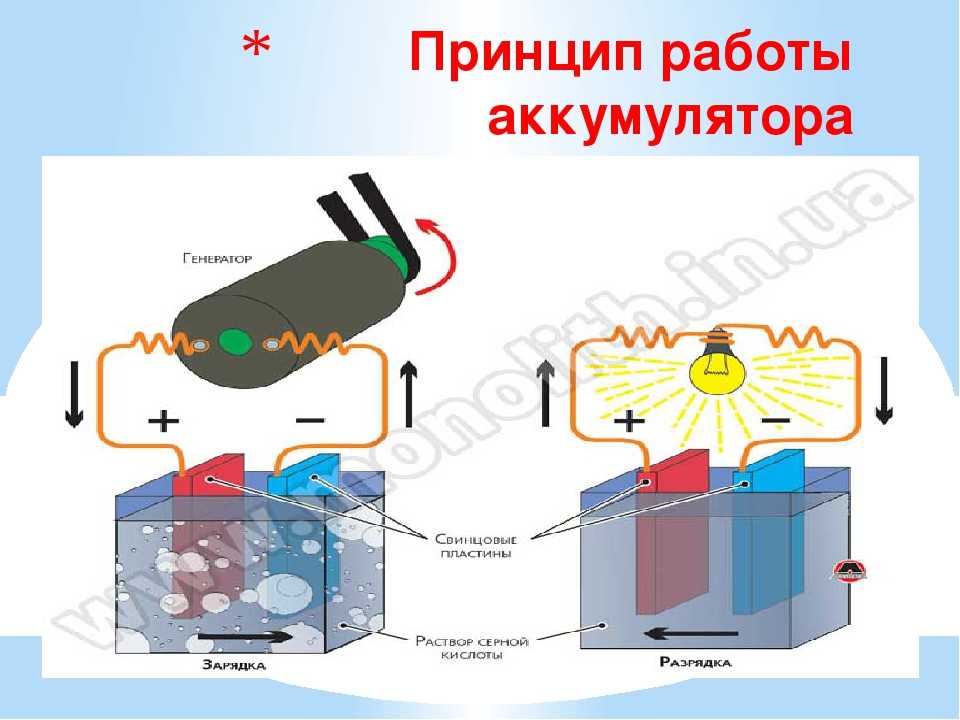 |
| Никель-кадмиевая или никель-кадмиевая батарея | Электроды никель-гидроксидно-кадмиевые. Электролит – гидроксид калия. |
| Цинк-угольная батарея или стандартная угольная батарея – | Цинк и углерод используются во всех обычных или стандартных сухих батареях AA, C и D. Электроды изготовлены из цинка и углерода, а паста из кислотных материалов между ними служит электролитом. |
ССЫЛКИ И ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
Potato Power: Руководство для учителя
История батареи
Электрохимические реакции
Углеродно-цинковая батарея
Как работают батареи Анимированное руководство по науке о батареях
Оценка
Вопросы:
М многократный
Выбор вопросов
1. В
В
аккумулятор плюсовая клемма называется:
а) анод
б) катод
в) электролит
г) провод
2.
Что заставляет электроны течь по проводу:
а) гравитационный потенциал выталкивает электроны через провод
б) кислоты проталкивают электроны по проводу
в) разность потенциалов между анодом и катодом толкает электроны
по проводу
г) электроны текут не по проводу, а по электролиту
3.
Какое утверждение о лимонной батарейке верно?
а) Энергия для батареи исходит не от лимона, а
скорее химическое изменение цинка (или другого металла)
б) Батарея состоит из двух металлических электродов разной
металлы, такие как медная монета или проволока и оцинкованный гвоздь.
 В результате протекает реакция окисления, и аккумулятор заряжается.
В результате протекает реакция окисления, и аккумулятор заряжается. Батарея в таком случае постоянно подпитывается от электросети, а при перебоях в электроснабжении – отдает накопленный заряд подключенному к ней оборудованию. Когда электроснабжение от сети восстанавливается, АКБ снова подзаряжается и находится в режиме постоянной готовности к дальнейшему использованию.
Батарея в таком случае постоянно подпитывается от электросети, а при перебоях в электроснабжении – отдает накопленный заряд подключенному к ней оборудованию. Когда электроснабжение от сети восстанавливается, АКБ снова подзаряжается и находится в режиме постоянной готовности к дальнейшему использованию.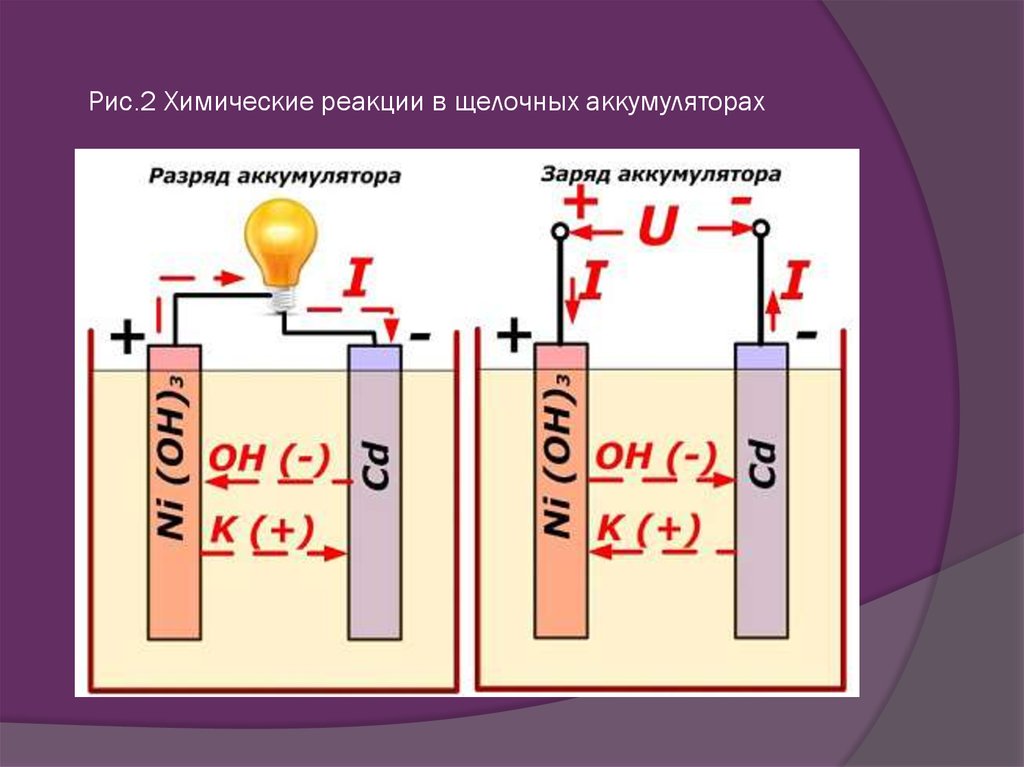
 К метро: 149₽. По России: от 200₽
К метро: 149₽. По России: от 200₽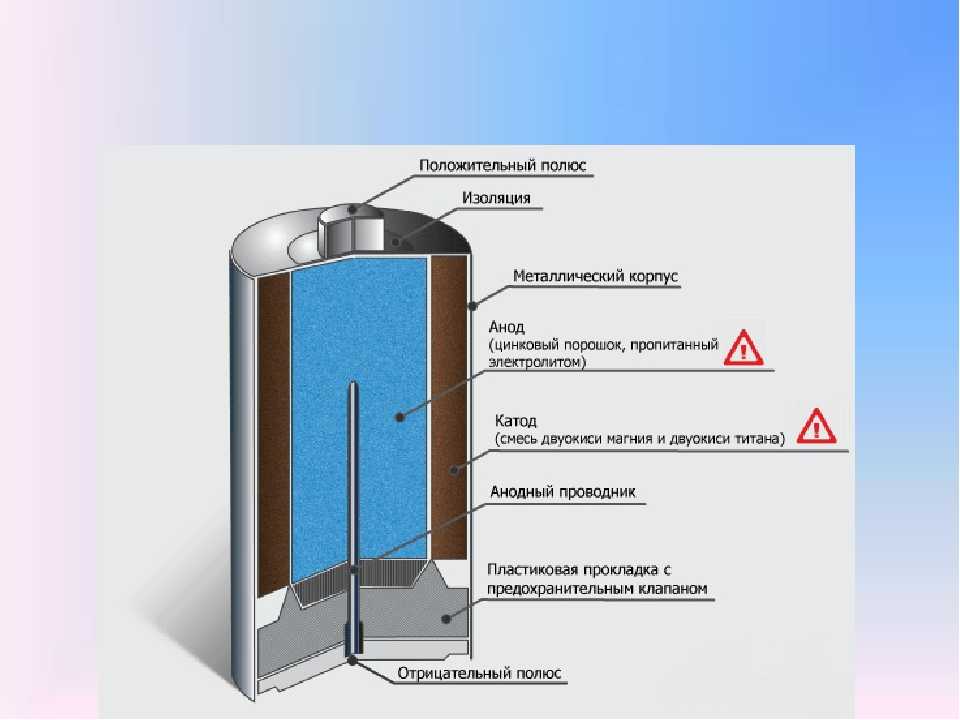 Цинк окисляется внутри лимона, обменивая часть своих электронов, чтобы достичь более низкого энергетического состояния, а высвобождаемая энергия обеспечивает энергию. Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе.
Цинк окисляется внутри лимона, обменивая часть своих электронов, чтобы достичь более низкого энергетического состояния, а высвобождаемая энергия обеспечивает энергию. Лимон просто обеспечивает среду, в которой это может произойти, но они не расходуются в процессе.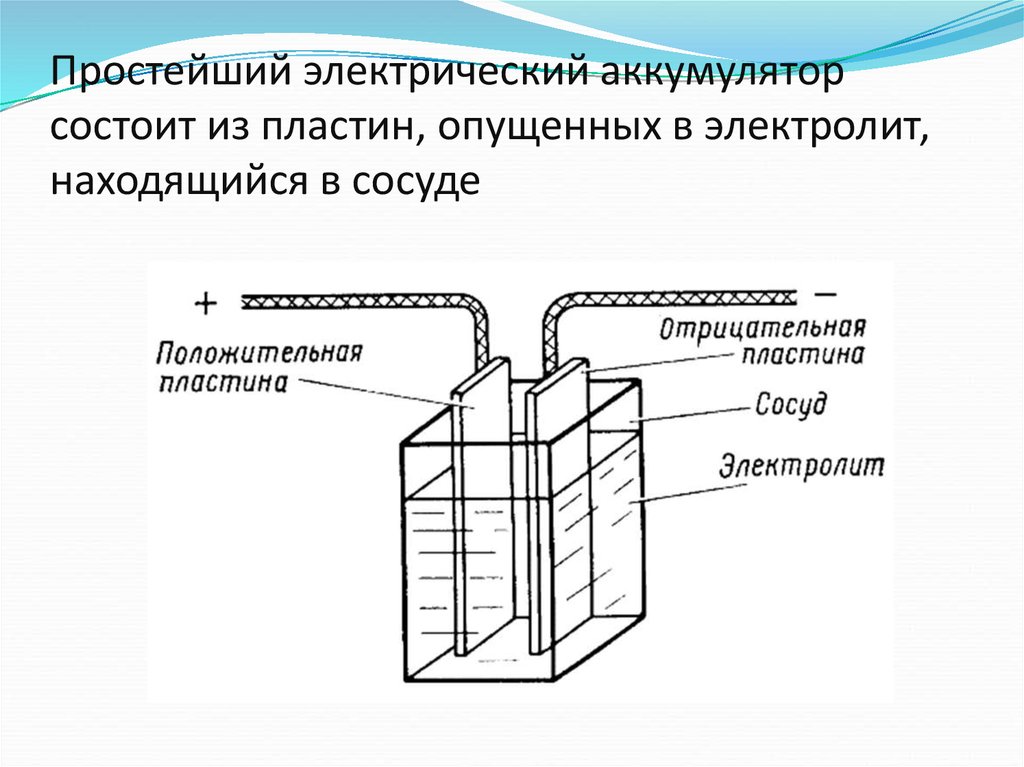 Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом.
Он состоит из двух электродов: один из цинка, другой из меди. Электролит представляет собой серную кислоту или смесь солевого раствора соли и воды. Электролит существует в форме 2H+ и SO42-. Цинк, который в электрохимическом ряду выше меди и водорода, реагирует с отрицательно заряженным сульфатом SO42- . Положительно заряженные ионы водорода (протоны) захватывают электроны меди, образуя пузырьки газообразного водорода h3. Это делает цинковый стержень отрицательным электродом, а медный стержень — положительным электродом. Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли.
Положительная клемма представляет собой угольный стержень, окруженный смесью диоксида марганца и угольного порошка. В качестве электролита используется паста из хлорида цинка и хлорида аммония, растворенных в воде. Углеродный (графитовый) стержень собирает электроны, поступающие от анодной части батареи, чтобы вернуться к катодной части батареи. Углерод является единственным практичным материалом проводника, потому что любой обычный металл быстро подвергается коррозии в положительном электроде в электролите на основе соли. Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как:
Возможны и другие побочные реакции, но общую реакцию в угольно-цинковом элементе можно представить как: