Катализаторы. Катализаторы это
Катализаторы - это... Что такое Катализаторы?
Катализа́тор — вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции (Химическая энциклопедия). Количество катализатора, в отличие от других реагентов, при реакции не изменяется. Обеспечивая более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно (сотни, миллионы раз) повторяется.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные.
Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный – образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества (Химическая энциклопедия). Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-востановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции (Имянитов, Temkin). Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
На дороги ежедневно выезжают миллионы автомобилей, и каждый из них - источник загрязнения воздуха. Особенно это чувствуется в крупных городах, где выхлопные газы автомобилей могут создавать большие проблемы.
В современных автомашинах присутствует каталитический преобразователь или автомобильный катализатор. Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) - ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения - один из главных компонентов смога, образуется за счет неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) - также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[1]
Источники
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru.
Литература
- Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443 — 1454. — 0132-344X.
- Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
Ссылки
См. также
Wikimedia Foundation. 2010.
dic.academic.ru
Катализатор | Химическая энциклопедия

Одно из наиболее эффективных воздействий на химические реакции – это применение катализатора. Катализаторы – это вещества, ускоряющие химические реакции. Присутствие катализаторов изменяет скорость реакции в тысячи и даже миллионы раз. Катализаторы активно участвуют в химической реакции, но в отличие от реагентов в конце ее остаются неизменными.
Катализаторы – это вещества, которые изменяют скорость протекания реакции, но сами не расходуются в ходе реакции и не входят в состав конечных продуктов.
Важной характеристикой каталитической реакции (катализа) является однородность или неоднородность катализатора и реагирующих веществ. Различают гомогенные и гетерогенные каталитические процессы. При гомогенном (однородном) катализе между реагирующими веществами и катализатором отсутствует поверхность раздела. В данном случае катализ осуществляется через образование неустойчивых промежуточных продуктов.
Например, вещество A должно вступить в реакцию с веществом B. Однако для начала реакции необходимо сильное нагревание, и реакция далее протекает медленно. Тогда подбирают катализатор с таким расчетом, чтобы он с веществом A образовал активное промежуточное соединение, способное потом энергично реагировать с веществом B:
A + Кат. = A ∙ Кат. A ∙ Кат. + B = AB ∙ Кат. Кат. A + B = AB
Процессы, в которых катализатор и катализируемые вещества находятся в разных агрегатных состояниях, относятся к гетерогенному (неоднородному) катализу. При адсорбции на поверхности катализатора газообразных или жидких реагентов ослабляются химические связи, возрастает способность этих веществ к взаимодействию.
Ускоряющее действие катализатора заключается в понижении энергии активации основной реакции. Каждый из промежуточных процессов с участием катализатора протекает с меньшей энергией активации, чем некатализируемая реакция. Катализ открывает иной пут протекания химической реакции от исходных веществ к продуктам реакции.
Опыт показывает, что катализаторы строго специфичны для конкретных реакций. Например, в реакции:
N2+3h3 =Fe 2Nh4
Катализатором является металлическое железо, а в реакции окисления оксида серы(IV) в оксид серы(VI) катализатор – оксид ванадия(V) V2O5. Часто в качестве катализаторов используют платину, никель, палладий, оксид алюминия. Для ускорения процесса разложения пероксида водорода в качестве катализатора применяют оксид марганца(IV). Если в стакан с раствором пероксида водорода добавить немного оксида марганца(IV), сразу происходит бурное вспенивание жидкости в результате выделения кислорода.
Катализатором реакции взаимодействия алюминия и йода является обычная вода. Если к смеси алюминия и йода прилить воду, то вещества в смеси бурно реагируют.
Существуют вещества, способные замедлять химическую реакцию – осуществлять так называемый отрицательный катализ. Их называют ингибиторами. Такие вещества применяют при необходимости замедлит некоторые процессы, например коррозию металлов, окисление сульфидов при хранении и др. Вам необходимо включить JavaScript, чтобы проголосовать
abouthist.net
КАТАЛИЗАТОРЫ - это... Что такое КАТАЛИЗАТОРЫ?
КАТАЛИЗАТОРЫ — вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Большой Энциклопедический словарь
катализаторы — [Словарь иностранных слов русского языка
Катализаторы — вещества, ускоряющие химические реакции (ср.: ингибиторы замедлители реакций). Биологические К. называются ферментами. Наиболее распространенными К. являются: синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Российская энциклопедия по охране труда
КАТАЛИЗАТОРЫ КЧ (КЦ) — катализаторы, применяемые в составе песчано смоляных смесей при изготовлении стержней в нагреваемой оснастке с карбамидофурановыми смолами марок: КФ 90 (Катализатор КЧ 41), КФ 40 (Катализатор КЦ 32), КФ 35 (Катализатор КЦ 51). Жидкости темно… … Металлургический словарь
Катализаторы — вещества, изменяющие скорость химических реакций посредством многократного промежуточного химического взаимодействия с участниками реакций и не входящие в состав конечных продуктов (см. Катализ). К. повсеместно распространены в живой… … Большая советская энциклопедия
Катализаторы — Катализатор вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции (Химическая энциклопедия). Количество катализатора, в отличие от других реагентов, при реакции не изменяется. Обеспечивая более быстрый путь для реакции,… … Википедия
катализаторы — вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Энциклопедический словарь
Катализаторы — (см. Катализ) вещества, как правило, ускоряющие (в противоположность ингибиторам) скорость химических реакций. Катализаторы не смещают равновесие, а изменяют скорости прямой и обратной реакций, способствуют скорейшему достижению равновесия.… … Начала современного естествознания
КАТАЛИЗАТОРЫ — в ва, изменяющие скорость хим. реакции. Обычно К. наз. лишь ускорители реакций, замедлители наз. ингибиторами. Биол. К. наз. ферментами. К. играют огромную роль в технике и природе (см. Катализ) … Большой энциклопедический политехнический словарь
КАТАЛИЗАТОРЫ — в ва, ускоряющие хим. реакции. В ва, замедляющие реакции, паз. ингибиторами. Биол. К. наз. ферментами. К. служат кислоты и основания, синтетич. алюмосиликаты, металлы платиновой группы, серебро, никель и др … Естествознание. Энциклопедический словарь
dic.academic.ru
Катализатор Википедия
Катализа́тор — химическое вещество, ускоряющее реакцию, но не расходующееся в процессе реакции.
Противоположное понятие — ингибитор.
Катализаторы в химии[ | код]
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества[1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO[1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции[2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня[2].
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях[ | код]
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
См. также[
ru-wiki.ru
Катализатор - это... Что такое Катализатор?
Катализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
Ссылки
dic.academic.ru
катализаторы - это... Что такое катализаторы?
КАТАЛИЗАТОРЫ — вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Большой Энциклопедический словарь
Катализаторы — вещества, ускоряющие химические реакции (ср.: ингибиторы замедлители реакций). Биологические К. называются ферментами. Наиболее распространенными К. являются: синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Российская энциклопедия по охране труда
КАТАЛИЗАТОРЫ КЧ (КЦ) — катализаторы, применяемые в составе песчано смоляных смесей при изготовлении стержней в нагреваемой оснастке с карбамидофурановыми смолами марок: КФ 90 (Катализатор КЧ 41), КФ 40 (Катализатор КЦ 32), КФ 35 (Катализатор КЦ 51). Жидкости темно… … Металлургический словарь
Катализаторы — вещества, изменяющие скорость химических реакций посредством многократного промежуточного химического взаимодействия с участниками реакций и не входящие в состав конечных продуктов (см. Катализ). К. повсеместно распространены в живой… … Большая советская энциклопедия
Катализаторы — Катализатор вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции (Химическая энциклопедия). Количество катализатора, в отличие от других реагентов, при реакции не изменяется. Обеспечивая более быстрый путь для реакции,… … Википедия
КАТАЛИЗАТОРЫ — в ва, изменяющие скорость хим. р ции или вызывающие ее, но не входящие в состав продуктов. Различают К. гомог. и гетерог. катализа. Типичные К. для гомог. катализа протонные и апротонные к ты, основания, нек рые комплексы металлов, для… … Химическая энциклопедия
катализаторы — вещества, ускоряющие химические реакции. Вещества, замедляющие реакции, называются ингибиторами. Биологические катализаторы называются ферментами. Катализаторами служат синтетические алюмосиликаты, металлы платиновой группы, серебро, никель и др … Энциклопедический словарь
Катализаторы — (см. Катализ) вещества, как правило, ускоряющие (в противоположность ингибиторам) скорость химических реакций. Катализаторы не смещают равновесие, а изменяют скорости прямой и обратной реакций, способствуют скорейшему достижению равновесия.… … Начала современного естествознания
КАТАЛИЗАТОРЫ — в ва, изменяющие скорость хим. реакции. Обычно К. наз. лишь ускорители реакций, замедлители наз. ингибиторами. Биол. К. наз. ферментами. К. играют огромную роль в технике и природе (см. Катализ) … Большой энциклопедический политехнический словарь
КАТАЛИЗАТОРЫ — в ва, ускоряющие хим. реакции. В ва, замедляющие реакции, паз. ингибиторами. Биол. К. наз. ферментами. К. служат кислоты и основания, синтетич. алюмосиликаты, металлы платиновой группы, серебро, никель и др … Естествознание. Энциклопедический словарь
dic.academic.ru
Катализ и катализаторы - Энциклопедия wiki.MPlast.by
Катализ – это процесс изменения скорости химической реакции при помощи катализаторов — веществ, принимающих участие в химической реакции, но в состав конечных продуктов не входящих и в результате реакции не расходующихся.
Одни катализаторы ускоряют реакцию (положительный катализ), другие – замедляют (отрицательный катализ). Отрицательный катализ называют ингибированием, а катализаторы, понижающие скорость химической реакции – ингибиторами.
Различают гомогенный и гетерогенный катализ.
Гомогенный катализ.
При гомогенном (однородном) катализе реагирующие вещества и катализатор находятся в одинаковом агрегатном состоянии и между ними отсутствует поверхность раздела. Пример гомогенного катализа – реакция окисления SO2 и SO3 в присутствии катализатора NO (реагирующие вещества и катализатор являются газами).
Гетерогенный катализ.
В случае гетерогенного (неоднородного) катализа реагирующие вещества и катализатор находятся в различных агрегатных состояниях и между ними существует поверхность (граница) раздела. Обычно катализатор – твердое вещество, а реагирующие вещества – жидкости или газы. Пример гетерогенного катализа – окисление NN3 до NO в присутствии Pt (катализатор – твердое вещество).
Механизм действия катализаторов
Действие положительных катализаторов сводится к понижению энергии активации реакции Еа(исх), действие ингибиторов – противоположное.
Так, для реакции 2HI = h3+I2 Еа(исх)=184 кДж/моль. Когда же эта реакция протекает в присутствии катализатора Au или Pt, то Еа(исх)=104 кДж/моль, соответственно.
Механизм действия катализатора при гомогенном катализе объясняется образованием промежуточных соединений между катализатором и одним из реагирующих веществ. Далее промежуточное соединение реагирует со вторым исходным веществом, в результате чего образуется продукт реакции и катализатор в первоначальном виде. Так как скорость обоих промежуточных процессов значительно больше скорости прямого процесса, то реакция с участием катализатора протекает значительно быстрее, чем без него.
Например, реакция:
SO2 +1/2 O2 = SO3 протекает очень медленно, а если использовать катализатор NO
то реакции NO +1/2О2 = NO2 и NO2 +SO2 = SO3 +NO протекают быстро.
Механизм действия катализатора при гетерогенном катализе иной. В этом случае реакция протекает вследствие адсорбции молекул реагирующих веществ поверхностью катализатора (поверхность катализатора неоднородна: на ней имеются так называемые активные центры, на которых и адсорбируются частицы реагирующих веществ.). Увеличение скорости химической реакции достигается, в основном, за счет понижения энергии активации адсорбированных молекул, а также, отчасти, за счет увеличения концентрации реагирующих веществ в местах, где произошла адсорбция.
Каталитические яды и промоторы.
Некоторые вещества снижают или полностью уничтожают активность катализатора, такие вещества называют каталитическими ядами. Например, небольшие примеси серы (0,1%) полностью прекращает каталитическое действие металлического катализатора (губчатого железа), использующегося при синтезе аммиака. Вещества, повышающие активность катализатора, называют промоторами. Например, каталитическая активность губчатого железа значительно возрастает при добавлении примерно 2% метаалюмината калия KAlO2.
Применение катализаторов
Действие катализатора избирательно и специфично. Это означает, что, применяя различные катализаторы, из одних и тех же веществ можно получить различные продукты. Это особенно характерно для реакций органических веществ. Например, в присутствии катализатора AlO3 происходит дегидратация этилового спирта, в присутствии Cu – дегидрирование: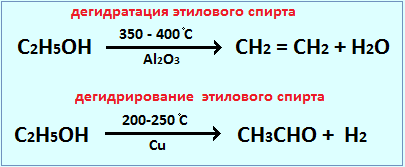
Биологические катализаторы, принимающие участие в сложных химических превращениях, протекающих в организме, называются ферментами.
Катализаторы широко используются в производстве серной кислоты, аммиака, каучука, пластмасс и др. веществ.
Автор: Метельский А.ВИсточник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 годДата в источнике: 1999 год
mplast.by